Nebenwirkungen von Arzneimitteln melden: Europaweite Kampagne soll Patientinnen und Patienten sensibilisieren
Pressemitteilung 11/16
Nummer 11/16 vom 07.11.2016
In einer gemeinsamen Kampagne fordern alle europäischen Arzneimittelbehörden derzeit Patientinnen und Patienten dazu auf, ihnen verstärkt Verdachtsfälle von unerwünschten Arzneimittelwirkungen (UAW) zu melden. In Deutschland werden diese Meldungen durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) sowie das Paul-Ehrlich-Institut (PEI), Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, bearbeitet. Beide Bundesinstitute weisen Patientinnen und Patienten ausdrücklich darauf hin, dass sie Verdachtsfälle auf Arzneimittelnebenwirkungen beziehungsweise Impfkomplikationen auch eigenständig und direkt an die Behörden melden können.
Die Meldungen leisten einen wichtigen Beitrag zur Arzneimittelsicherheit, denn um Arzneimittelrisiken möglichst schnell identifizieren zu können, sind die Arzneimittelbehörden auf belastbare Daten und Risikosignale aus der Praxis angewiesen. „Je früher, häufiger und detaillierter die Arzneimittelbehörden Meldungen erhalten, desto früher können diese Risikosignale erkannt und bewertet werden, um bei Bedarf Maßnahmen zum Schutz der Patientinnen und Patienten zu treffen“, so Prof. Dr. Karl Broich, Präsident des BfArM. Aufgrund gesetzlicher Meldeverpflichtung erhalten die für Arzneimittel zuständigen Bundesinstitute diese Meldungen von Pharmaunternehmen sowie von Ärzten und Apothekern bzw. deren Arzneimittelkommissionen. Prof. Dr. Klaus Cichutek, der Präsident des Paul-Ehrlich-Instituts, ergänzt dazu: „Seit 2012 können auch Patientinnen und Patienten, deren Angehörigen oder Freunde Verdachtsfälle von Nebenwirkungen direkt über ein Online-Formular an PEI und BfArM melden. Nutzen Sie bitte diese Möglichkeit, im Interesse aller Beteiligten“.
Die Arzneimittelüberwachungsbehörden filtern aus der Fülle der berichteten Symptome diejenigen heraus, die möglicherweise ein erstes Signal für eine bisher unbekannte Nebenwirkung sind.
Erfahrungsgemäß werden jedoch nicht alle möglichen Verdachtsfälle gemeldet. Die Gründe dafür sind vielfältig. So informieren Patientinnen und Patienten ihren Arzt nicht über jede Beobachtung oder der Zusammenhang zwischen einer Reaktion oder einem Symptom und dem Arzneimittel wird nicht hergestellt, weil beispielsweise die Symptome einer Grunderkrankung zugeordnet werden. Nebenwirkungen zu Arzneimitteln, die sich bereits länger auf dem Markt befinden, werden bekanntermaßen weniger häufig gemeldet als solche von neuen Arzneimitteln.
Sollte ein Verdacht noch nicht durch den Arzt oder Apotheker gemeldet worden sein, oder Betroffene sind unsicher, ob eine solche Meldung erfolgt ist, besteht für sie die Möglichkeit, diese Meldung auch selbst vorzunehmen. Sowohl das BfArM als auch das PEI bieten dazu auf ihren Internetseiten ein speziell für Verbraucher konzipiertes Online-Meldeformular an sowie einen Meldebogen, mit dem Verdachtsfälle auch per Brief oder Fax gemeldet werden können:
www.bfarm.de/uawmelden
www.pei.de/uawmelden
Wenn Sie den Verdacht einer Nebenwirkung melden möchten, beachten Sie bitte auch folgende Hinweise:
- Die Meldung der Nebenwirkung ersetzt nicht den Arztbesuch. Nur der behandelnde Arzt kann und darf beurteilen, ob beispielsweise eine Dosisreduktion oder gar ein Absetzen des verdächtigten Medikaments notwendig und medizinisch sinnvoll ist.
- Auch für BfArM und PEI ist die medizinische Beurteilung des Falles durch einen Arzt oder eine Ärztin, die den Patienten und die medizinischen Hintergründe gut kennt, eine wichtige Informationsquelle. Es ist daher ein großes Anliegen der Behörden an die Meldenden, dass sie BfArM oder PEI solche Informationen zusätzlich zukommen lassen. Eventuell vorhandene Arztbriefe oder Krankenhausberichte sollten der eigentlichen Meldung daher zusätzlich beigefügt werden.
Die Daten werden über eine gesicherte Verbindung in die Datenbank übermittelt und selbstverständlich vertraulich behandelt.
Im Rahmen der Kampagne stellen das BfArM und das PEI auch eine kurze Animation zur Verfügung, die erklärt, warum die Meldung von Nebenwirkungen wichtig ist.
Zuständigkeiten der Bundesinstitute
Beide Bundesoberbehörden sammeln, registrieren und bewerten Nebenwirkungen in ihrem jeweiligen Zuständigkeitsbereich. Das Paul-Ehrlich-Institut ist im Bereich der Human-Arzneimittel zuständig für Impfstoffe, Sera (einschließlich monoklonaler Antikörper, Antikörperfragmente oder Fusionsproteine mit einem funktionellen Antikörperbestandteil), Blut-, Knochenmark- und Gewebezubereitungen, Allergene, Arzneimittel für neuartige Therapien und gentechnisch hergestellte Blutbestandteile. Für alle anderen Arzneimittel ist das BfArM zuständig.
Beobachtung von Arzneimitteln nach der Zulassung
Die Kenntnisse über die Sicherheit von Arzneimitteln sind zum Zeitpunkt ihrer erstmaligen Zulassung nicht vollständig. Dies ergibt sich vor allem daraus, dass die klinische Erprobung eines Arzneimittels an einer relativ geringen Zahl von Patienten durchgeführt wird. Seltene oder sehr seltene unerwünschte Wirkungen, Wechselwirkungen oder andere Risiken im Zusammenhang mit der Arzneimittelanwendung können in klinischen Prüfungen üblicherweise nicht erkannt werden. Diese Patientinnen und Patienten sind zudem unter verschiedenen Aspekten für die klinische Prüfung besonders ausgewählt worden, was nicht notwendigerweise den Bedingungen bei der breiten Anwendung des Arzneimittels entspricht.
Das Arzneimittelgesetz der Bundesrepublik Deutschland sieht deshalb vor, dass nach der Zulassung eines Arzneimittels die Erfahrungen bei seiner Anwendung fortlaufend und systematisch gesammelt und ausgewertet werden. Dies ist eine der Aufgaben des BfArM und des PEI. Die Meldung von Verdachtsfällen auf Nebenwirkungen ist hierzu ein wichtiger Baustein.
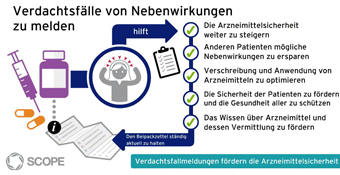
Animation: Verdachtsfallmeldungen fördern die Arzneimittelsicherheit
Grafik: Verdachtsfallmeldungen fördern die Arzneimittelsicherheit
Anzahl der UAW-Berichte (Inland, Netto)

Anzahl der Eingänge zu Verdachtsfällen aus Deutschland
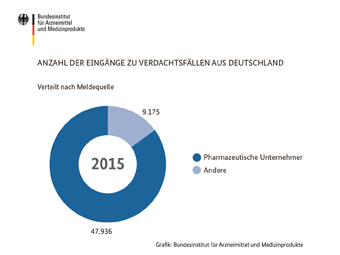
Quellenangabe: BfArM
