Fälschung des Arzneimittels Ozempic®
15.02.2024: Fälschung des Arzneimittels Ozempic®: aktuelle Informationen
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) informiert über aktuelle Entwicklungen im Falle der Fälschung des Arzneimittels Ozempic® der Firma Novo Nordisk A/S in deutscher Aufmachung. Das BfArM hatte in Absprache mit den betroffenen Bundesländern am 11.10.2023 die Koordination des Fälschungsfalles gemäß § 62 Absatz 1 AMG übernommen.
Da die Fälschung anhand der Sekundärverpackung nur schwer bis gar nicht erkennbar ist, hatte das BfArM in Abstimmung mit den Bundesländern am 11.10.2023 im Sinne der Patientensicherheit eine Empfehlung an die Apothekerschaft gerichtet, vor der Abgabe des Arzneimittels an Patientinnen und Patienten jede Primärverpackung auf ihre Echtheit zu prüfen.
In den vergangenen Monaten wurden keine weiteren Hinweise entdeckt, dass sich weiterhin gefälschte Arzneimittel in Deutschland in der legalen Vertriebskette befinden. Neben der bisher bekannten Fälschung des Arzneimittels Ozempic 1 mg (Produktcode: 04150153985573; Seriennummer: 1946483405690; Charge: MP5E511) wurden weder weitere Packungen der gefälschten Seriennummer noch Fälschungen mit anderen Seriennummern identifiziert.
Mit securPharm steht ein gut funktionierendes System zur Verfügung, mit dem der Versuch einer doppelten Ausbuchung sofort angezeigt wird. So wird das System unmittelbar einen Alarm auslösen, wenn der bekannte Data-Matrix-Code erneut abgescannt werden würde.
Da keine neuen Fälschungen identifiziert wurden und mit dem securPharm-System Abgaben der Fälschung sicher verhindert werden können, wurde in einer weiteren Bund-Länder Abstimmung vereinbart, die Empfehlung an die Apotheken, jede Packung Ozempic vor Abgabe zu öffnen und zu überprüfen, aufzuheben. Das BfArM dankt den Apothekerinnen und Apothekern für den geleisteten Mehraufwand.
Die weiteren Ermittlungen in dem Fall liegen bei den Polizeibehörden und den zuständigen Staatsanwaltschaften. Diese Ermittlungen sind noch nicht abgeschlossen. Das BfArM steht weiterhin in engem Kontakt mit den Landesbehörden, die in Deutschland für die Überwachung des Verkehrs mit Arzneimitteln zuständig sind, und den Behörden im Ausland sowie der Europäischen Arzneimittelagentur (EMA). Sobald weitere relevante Informationen vorliegen, wird das BfArM entsprechend informieren.
10.11.2023: Fälschung des Arzneimittels Ozempic®: aktuelle Entwicklungen
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) informiert über wichtige aktuelle Entwicklungen im Falle der Fälschung des Arzneimittels Ozempic® des Originalherstellers Novo Nordisk A/S in deutscher Aufmachung.
Untersuchungen des Zulassungsinhabers Novo Nordisk A/S haben ergeben, dass sich in beschlagnahmten Sekundärverpackungen der bisher verifizierten Fälschung (Seriennummer: 1946483405690 der Charge: MP5E511, Verfalldatum: 07/2025) weitere vermutlich umetikettierte Insulinpens befunden haben. Analysen ergaben, dass in beiden Pens kein Semaglutid, jedoch Insulin enthalten ist.
Von den Fälschungen geht eine erhebliche Gesundheitsgefährdung aus.
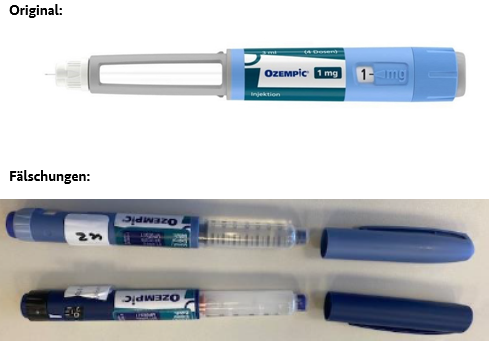
Da nicht auszuschließen ist, dass auch weitere Pensysteme als Fälschung genutzt werden können, ist es notwendig den Original Ozempic® Pen eindeutig zu identifizieren. Der Ozempic® Pen enthält ausschließlich klare Lösung in einem Sichtfenster ohne Skalierung und zeigt die Dosierung in mg an. Die bisher aufgefundenen Fälschungen haben neben farblichen Abweichungen zudem einen Dosiswähler, der beim Einstellen der Dosis über den Pen hinausragt (Fotos von Original und Fälschungen siehe unten).
Die Untersuchungen zu diesem Fall sind noch nicht abgeschlossen. Die Polizeibehörden sind informiert. Das BfArM steht weiterhin in engem Kontakt mit den Landesbehörden, die in Deutschland für die Überwachung des Verkehrs mit Arzneimitteln zuständig sind, und den Behörden im Ausland sowie der Europäischen Arzneimittelagentur (EMA). Sobald weitere Informationen vorliegen, wird das BfArM unverzüglich darüber informieren.
07.11.2023: Fälschung des Arzneimittels Ozempic®: aktuelle Entwicklungen
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) informiert über wichtige aktuelle Entwicklungen im Falle der Fälschung des Arzneimittels Ozempic® des Originalherstellers Novo Nordisk A/S in deutscher Aufmachung.
Erste Untersuchungen des Herstellers Novo Nordisk A/S haben ergeben, dass sich in der bisher identifizierten Fälschung des Arzneimittels Ozempic® (Seriennummer: 1946483405690 der Charge: MP5E511, Verfalldatum: 07/2025) kein Semaglutid befindet. Entsprechend der Ergebnisse des deutschen amtlichen Untersuchungslabors Chemisches und Veterinäruntersuchungsamt (CVUA) Karlsruhe enthalten die betroffenen Pens Insulin. Es wird aktuell vermutet, dass es sich um umetikettierte Insulinpens handelt. Die Untersuchungen hierzu sind noch nicht abgeschlossen.
Von den Fälschungen geht eine erhebliche Gesundheitsgefährdung aus.
In Österreich haben Ozempic®-Fälschungen bereits Patientinnen und Patienten erreicht. Der Hersteller von Ozempic®, Novo Nordisk A/S, hat am 30.10.2023 daher in Österreich eine umfassende Patientinnen- und Patienten-Information zur Identifizierung von Original Ozempic®- und Saxenda®-Pens veröffentlicht. Dem BfArM sind für Deutschland aktuell keine Meldungen zu Fälschungen von Saxenda® bekannt. Saxenda® (Wirkstoff: Liraglutid) ist ein verschreibungspflichtiges Arzneimittel, das als Ergänzung zu einer kalorienreduzierten Ernährung und verstärkter körperlicher Aktivität zur Gewichtsregulierung bei Erwachsenen angewendet wird.
Bisher liegen keine Erkenntnisse vor, dass die Fälschungen Patientinnen oder Patienten in Deutschland erreicht haben. Es ist jedoch weiterhin nicht auszuschließen, dass sich gefälschtes Ozempic® in Deutschland in der Vertriebskette befindet.
Alle Apothekerinnen und Apotheker werden daher weiterhin gebeten, bis auf Weiteres vor der Abgabe des Arzneimittels an Patientinnen und Patienten jede Primärverpackung Ozempic® auf ihre Echtheit zu überprüfen. Dies kann auf Basis der untenstehenden Fotos erfolgen. Packungen, die einen Alarm im securPharm-System hervorrufen oder in anderer Weise auffällig sind, dürfen nicht abgegeben werden. Solche Arzneimittel sind umgehend zu quarantänisieren. Es sind ebenfalls umgehend die zuständigen Überwachungsbehörden zu informieren.
Die Untersuchungen zu diesem Fall sind noch nicht abgeschlossen. Die Polizeibehörden sind informiert. Das BfArM steht weiterhin in engem Kontakt mit den Landesbehörden, die in Deutschland für die Überwachung des Verkehrs mit Arzneimitteln zuständig sind, und den Behörden im Ausland sowie der Europäischen Arzneimittelagentur (EMA). Sobald weitere Informationen vorliegen, wird das BfArM unverzüglich darüber informieren.
11.10.2023: Fälschung des Arzneimittels Ozempic®: aktuelle Entwicklungen und notwendige Maßnahmen
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) informiert über wichtige aktuelle Entwicklungen und notwendige Maßnahmen im Falle der Fälschung des Arzneimittels Ozempic® des Originalherstellers Novo Nordisk A/S in deutscher Aufmachung. Auf Grund aktueller Entwicklungen hat das BfArM in Absprache mit den betroffenen Bundesländern die Koordination des Fälschungsfalles übernommen.
Nach jetzigem Kenntnistand sind Fälschungen bei Packungen der Stärke 1 mg (Produktcode: 04150153985573; Packungsgröße 3 Stück) mit den folgenden Serialisierungsinformationen auf Ebene des Großhandels identifiziert worden:
• Seriennummer: 1946483405690 der Charge: MP5E511, Verfalldatum: 07/2025
Eine weitere im Rahmen der noch laufenden Untersuchungen identifizierte Fälschung der Stärke 1 mg, die bisher dem Großhandel angeboten wurde, trägt die folgenden Serialisierungsinformationen:
• Seriennummer: 1031002838555 der Charge: NP5G866, Verfalldatum: 12/2025
Diese Fälschung wurde bisher noch nicht in der Vertriebskette aufgefunden.
Da es sich um zwei Originalchargen des Arzneimittels handelt sind nicht alle Packungen der oben genannten Chargen betroffen. Es ist zum aktuellen Zeitpunkt nicht auszuschließen, dass noch weitere Packungen mit anderer Seriennummer derselben oder einer anderen Charge oder auch anderer Wirkstärke betroffen sein könnten.
Grundsätzlich hat jede einzelne Packung eines verschreibungspflichtigen Arzneimittels einen eindeutigen Code. Wird versucht diesen Code mehrfach auszubuchen, so kommt es im securPharm-System zu einer Alarmmeldung.
Bisher liegen keine Erkenntnisse vor, dass die Fälschungen Patientinnen oder Patienten in Deutschland erreicht haben. Es ist jedoch weiterhin nicht auszuschließen, dass sich gefälschte Arzneimittel in Deutschland in der Vertriebskette befinden.
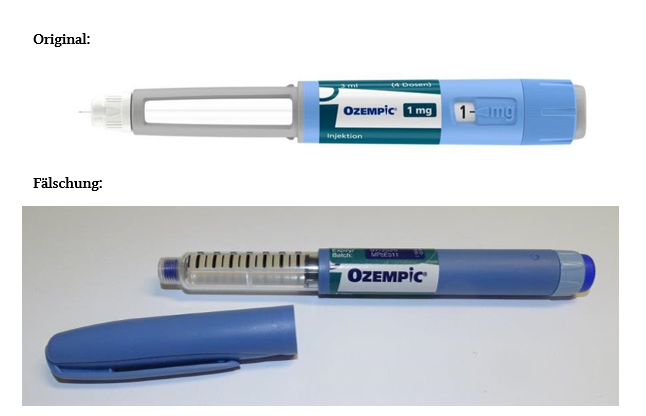
Die bisher identifizierten Fälschungen sind nur schwer bis gar nicht an der Sekundärverpackung vom Original zu unterscheiden, sondern nur an der Primärverpackung (siehe Fotos unten).
Alle Apothekerinnen und Apotheker werden daher darum gebeten bis auf Weiteres vor der Abgabe des Arzneimittels an Patientinnen und Patienten jede Primärverpackung auf ihre Echtheit zu prüfen. Dies kann auf Basis der untenstehenden Fotos erfolgen. Packungen, die einen Alarm im securPharm-System hervorrufen oder in anderer Weise auffällig sind, dürfen aufgrund der möglichen erheblichen Gesundheitsgefährdung, die von den Fälschungen ausgehen kann, nicht abgegeben werden. Diese Arzneimittel sind umgehend zu quarantänisieren. Es sind ebenfalls umgehend die zuständigen Überwachungsbehörden zu informieren.
Ozempic® ist ein verschreibungspflichtiges Arzneimittel, das zur Behandlung des unzureichend kotrollierten Diabetes mellitus Typ 2 bei Erwachsenen als Zusatz zu Diät und körperlicher Aktivität angewendet wird.
Derzeit erfolgt die Untersuchung durch den Zulassungsinhaber Novo Nordisk. Das BfArM ist in engem Austausch mit der Firma sowie den zuständigen Landesüberwachungsbehörden. Die Untersuchungen zu diesem Fall sind noch nicht abgeschlossen. Die Polizeibehörden sind informiert. Das BfArM steht weiterhin in engem Kontakt mit den Landesbehörden, die in Deutschland für die Überwachung des Verkehrs mit Arzneimitteln zuständig sind, und den Behörden im Ausland sowie der Europäischen Arzneimittelagentur (EMA). Sobald weitere Informationen vorliegen, wird das BfArM unverzüglich darüber informieren.
siehe auch Pressemitteilung vom 11.10.2023
06.10.2023: Ozempic® Injektionslösung im Fertigpen: Fälschungen in deutscher Aufmachung im deutschen Markt aufgetaucht
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) weist auf eine dringende Warnmeldung des Regierungspräsidiums Freiburg hin, in der vor Fälschungen des Arzneimittels Ozempic® des Originalherstellers Novo Nordisk A/S in deutscher Aufmachung gewarnt wird. Es ist nicht auszuschließen, dass sich die Fälschung in Deutschland im Vertrieb befindet.
Aufgrund der möglichen erheblichen Gesundheitsgefährdung, die von den Fälschungen ausgehen kann, dürfen betroffene Packungen nicht angewendet werden.
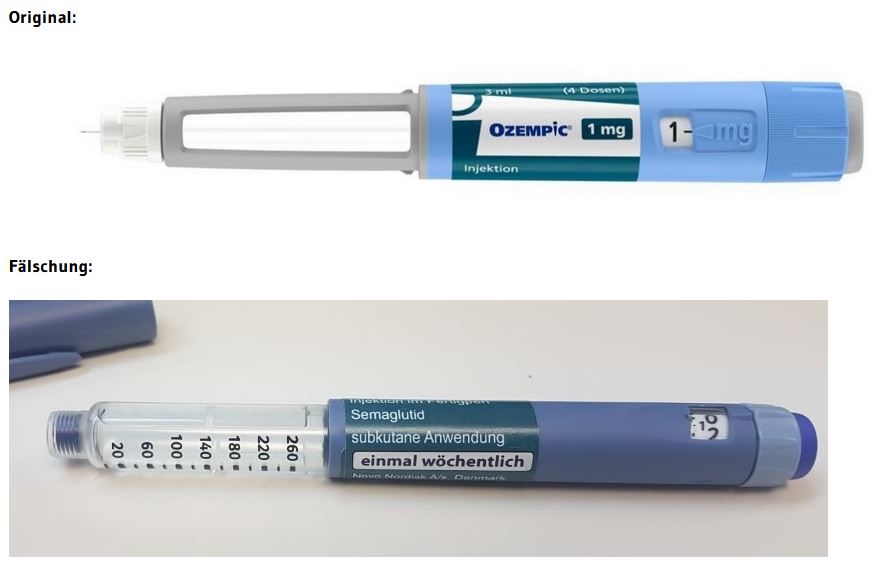
Die Fälschung ist optisch leicht zu erkennen (siehe Fotos unten).
Ozempic® ist ein verschreibungspflichtiges Arzneimittel, das zur Behandlung des unzureichend kontrollierten Diabetes mellitus Typ 2 bei Erwachsenen als Zusatz zu Diät und körperlicher Aktivität angewendet wird.
Die Untersuchungen zu diesem Fall sind noch nicht abgeschlossen. Das BfArM steht in engem Kontakt mit den Landesbehörden, die in Deutschland für die Überwachung des Verkehrs mit Arzneimitteln zuständig sind und den Behörden im Ausland. Sobald weitere Informationen vorliegen, wird das BfArM unverzüglich darüber informieren.

Hinweise für Fachkreise sowie Patientinnen und Patienten
Haben Fälschungen des Arzneimittels Ozempic Patientinnen oder Patienten in Deutschland erreicht?
Bisher liegen keine Erkenntnisse vor, dass Fälschungen des Arzneimittels Patientinnen oder Patienten erreicht haben. Es wurden gefälschte Packungen auf Großhandelsebene festgestellt. Es gibt keine Hinweise darauf, dass sich weiterhin gefälschte Arzneimittel in Deutschland in der legalen Vertriebskette befinden.
Wie sind die Fälschungen zu erkennen?
Die bisher identifizierten Fälschungen sind nur schwer bis gar nicht an der Sekundärverpackung vom Original zu unterscheiden, jedoch leicht an der Primärverpackung (siehe Fotos).

Welche Rolle spielt securPharm e.V. bei der Abwehr von Fälschungen in der legalen Lieferkette in Deutschland?
Die Hürden gefälschte Arzneimittel in Deutschland in die legale Lieferkette einzuschleusen sind seit der Umsetzung der Fälschungsschutzrichtlinie in 2019 erheblich. Grundsätzlich hat jede einzelne Packung eines verschreibungspflichtigen Arzneimittels einen eindeutigen Code. Wird dieser mehrfach ausgebucht, kann es sich um eine Arzneimittelfälschung handeln.
Was kann ich als Patientin oder Patient tun, wenn ich glaube, dass mein Ozempic-Arzneimittel gefälscht ist?
Wenden Sie sich bitte mit Ihrer Packung an eine Apotheke. Diese kann die Echtheit des Arzneimittels überprüfen und ggf. weitere Maßnahmen veranlassen.
Welche Aufgaben hat das BfArM?
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) informiert über wichtige aktuelle Entwicklungen und notwendige Maßnahmen im Falle der Fälschung des Arzneimittels Ozempic® des Originalherstellers Novo Nordisk A/S. Das BfArM hat in Absprache mit den betroffenen Bundesländern die Koordination des Fälschungsfalles übernommen.
Wie ist der Stand der Untersuchungen?
Die weiteren Ermittlungen in diesem Fall liegen bei den Polizeibehörden und den zuständigen Staatsanwaltschaften. Diese Ermittlungen sind noch nicht abgeschlossen. Das BfArM steht in engem Kontakt mit den zuständigen Behörden und wird unverzüglich informieren, sobald weitere Informationen vorliegen.
Weitere Informationen und Pressemitteilungen
Pressemitteilungen und weitere Informationen finden Sie unter:
05.10.2023 Pressemitteilung: Regierungspräsidium Freiburg warnt vor gefälschtem Arzneimittel
