
Die zunehmende Bedeutung von Indikationserweiterungen für Krebsmedikamente
BlogTesaser_Stand
Indikationserweiterungen bei Krebsmedikamenten tragen einen wichtigen Teil des therapeutischen Fortschritts.
Antineoplastische Mittel sind der größte Bereich zentral zugelassener Arzneimittel in der EU.
Das europäische zentralisierte Verfahren (centralised procedure, CP) der Europäischen Arzneimittelagentur (EMA), zu dem auch die deutschen Zulassungsbehörden wesentlich beitragen, ist seit 2004 für alle innovativen Arzneimittel zur Behandlung von Krebs verpflichtend. Bislang gibt es europäische Marktzulassungen für etwa 200 neue Wirkstoffe zur Behandlung von Krebs, die über das CP zugelassen wurden.
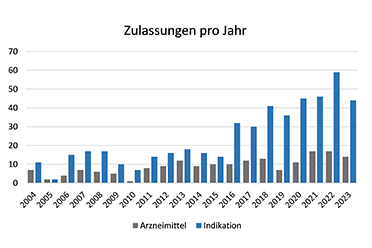
Dabei hat die Entwicklung neuer Krebsmedikamente seit der Einführung des CP erheblich zugenommen. In der Anfangsphase zwischen 2004 und 2010 wurden von der Europäischen Kommission durchschnittlich Krebsarzneimittel mit 5 neuen Wirkstoffen pro Jahr zugelassen, zwischen 2011 und 2023 stieg diese Anzahl auf fast das Dreifache, auf 11 pro Jahr.
Bemerkenswert ist, dass die Zahl der neu zugelassenen Arzneimittel nur einen Teil des schnellen Fortschritts bei der Entwicklung innovativer Krebsmedikamente widerspiegelt. Nicht nur neue Wirkstoffe, sondern auch zusätzliche Indikationen für bereits zugelassene Arzneimittel eröffnen neue Behandlungsmöglichkeiten für Patientinnen und Patienten.
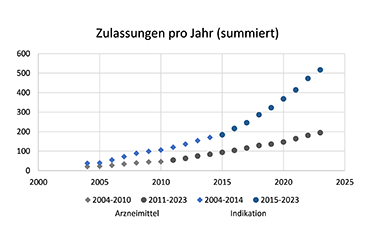
Während die Zahl der medizinischen Krebsmedikamente offensichtlich zunimmt, ist die Zahl der Verfahren für zusätzliche Indikationen für bereits zugelassene Arzneimitteln in den letzten Jahren deutlich schneller gestiegen als die Zahl der neu zugelassenen Arzneimittel. Zwischen 2004 und 2015 gab es durchschnittlich 13 Indikationserweiterungen pro Jahr. Ab 2015 stieg die Zahl stark auf 33 Indikationserweiterungen pro Jahr an. Vergleicht man die Zahl der neuen Wirkstoffe mit der Zahl der zusätzlichen Indikationen gab es bis 2014 jeweils 1,66 Indikationserweiterungen pro neuem Wirkstoff pro Jahr. Dieser Anteil stieg zwischen 2015 und 2022 auf 3,42.
Die wissenschaftliche Bewertung der neuen Arzneimittel und der neuen Indikationen wird von den Assessorinnen und Assessoren in den verschiedenen nationalen Zulassungsbehörden des europäischen Netzwerks gemacht, für Deutschland im BfArM und im Paul-Ehrlich-Institut). Die veränderte zahlenmäßige Verteilung von Anträgen zu neuen Arzneimitteln versus Anträgen für neue Indikationen bereits zugelassener Arzneimittel bedingt eine Verschiebung in der Art der für die Bewertung der Krebsmedikamente benötigte Expertise. Die Ausweitung der Verwendung eines zugelassenen Krebsmedikaments auf eine neue Tumorart erfordert in der Regel eine vollständige Nutzen-Risiko-Bewertung der klinischen Daten, während für die pharmazeutische Qualität und/oder aus nicht-klinischen Studien nur wenige oder gar keine neuen Daten zu erwarten sind. Dementsprechend werden durch verschieden Initiativen die Kapazitäten für die klinische Bewertung von Krebsmedikamenten im europäischen Regulierungsnetzwerk erhöht, beispielsweise durch das EU4Health Programme Joint Action IncreaseNET und das EMA HMA Pilot Educational Program Oncology.
