Wissenswertes zu DiGA
Was ist eine digitale Gesundheitsanwendung (DiGA)?
Digitale Gesundheitsanwendungen (DiGA) eröffnen vielfältige Möglichkeiten, um bei der Erkennung und Behandlung von Krankheiten sowie auf dem Weg zu einer selbstbestimmten gesundheitsförderlichen Lebensführung zu unterstützen. DiGA sind damit „digitale Helfer“ in der Hand der Patientinnen und Patienten.
Eine DiGA ist ein CE-gekennzeichnetes Medizinprodukt, das folgende Eigenschaften hat:
- Medizinprodukt der Risikoklasse I oder IIa nach MDR oder, im Rahmen der Übergangsvorschriften, nach MDD (Hinweise zur Frage „wann ist eine App ein Medizinprodukt?“ finden Sie unter Abgrenzung und Klassifizierung)
- Die Hauptfunktion der DiGA beruht auf digitalen Technologien.
- Der medizinische Zweck wird wesentlich durch die digitale Hauptfunktion erreicht.
- Die DiGA unterstützt die Erkennung, Überwachung, Behandlung oder Linderung von Krankheiten oder die Erkennung, Behandlung, Linderung oder Kompensierung von Verletzungen oder Behinderungen.
- Die DiGA wird vom Patienten oder von Leistungserbringer und Patient gemeinsam genutzt.
Die Anforderungen sind in § 33a Fünftes Buch Sozialgesetzbuch (SGB V) definiert.
Rechtliche Grundlagen: Digitale-Versorgung-Gesetz (DVG) und Digitale Gesundheitsanwendungen-Verordnung (DiGAV)
Mit dem Inkrafttreten des Digitale-Versorgung-Gesetzes (DVG) am 19. Dezember 2019 wurde die „App auf Rezept“ für Patientinnen und Patienten in die Gesundheitsversorgung eingeführt (§§ 33a und 139e Fünftes Buch Sozialgesetzbuch). Damit haben ca. 73 Millionen Versicherte in der gesetzlichen Krankenversicherung einen Anspruch auf eine Versorgung mit DiGA, die von Ärzten und Psychotherapeuten verordnet werden können und durch die Krankenkasse erstattet werden.
Voraussetzung hierfür ist, dass die DiGA ein Prüfverfahren beim BfArM erfolgreich durchlaufen haben und in einem neu zu schaffenden Verzeichnis erstattungsfähiger digitaler Gesundheitsanwendungen (DiGA-Verzeichnis) gelistet sind. In diesem Verzeichnis werden für Ärzte, Psychotherapeuten und Nutzer wesentliche Informationen zur DiGA zusammenfassend dargestellt. Dies sorgt für umfangreiche Transparenz, damit gut informierte Entscheidungen getroffen werden können und eine vertrauensvolle Nutzung möglich wird.
Details zu diesem Verfahren regelt eine ergänzende Rechtsverordnung des Bundesministeriums für Gesundheit (BMG), die Digitale Gesundheitsanwendungen-Verordnung (DiGAV).
FAQ Änderungen durch das DigiG
Digitale Gesundheitsanwendungen (DiGA) sollen besser in Versorgungsprozesse integriert werden und auch komplexere Behandlungsprozesse ermöglichen. Die folgenden FAQs zu den Änderungen durch das DigiG enthalten Antworten auf die wichtigsten Änderungen im Zusammenhang mit DiGA.
Das Bewertungsverfahren beim BfArM
Das Verfahren ist als zügiger „Fast-Track“ konzipiert: Die Bewertungszeit durch das BfArM beträgt höchstens drei Monate nach Eingang des vollständigen Antrags. Kern des Verfahrens sind die Prüfung der Herstellerangaben zu den geforderten Produkteigenschaften – vom Datenschutz bis zur Benutzerfreundlichkeit – sowie die Prüfung eines durch den Hersteller beizubringenden Nachweises für die mit der DiGA realisierbaren positiven Versorgungseffekte. Das sind Effekte, durch die sich der gesundheitliche Zustand eines Patienten oder die Möglichkeiten zum Umgang mit seiner Erkrankung durch die Benutzung der DiGA verbessern.
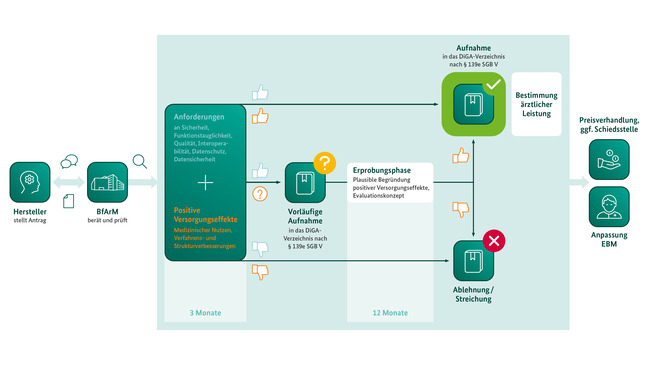
Wichtige Hinweise zum Verfahrensablauf, zum Antragsverfahren und zur Nachweisführung hat das BfArM in einem Leitfaden aufbereitet.
Prüfverfahren zu Datenschutz und Datensicherheit
Bei der Antragsbewertung prüft das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) im Rahmen seines gesetzlichen Auftrags und nach den Vorgaben der Datenschutz-Grundverordnung (DSGVO) sowie §§ 4 bis 6 der Digitale Gesundheitsanwendungen-Verordnung (DiGAV) u. a. die Angaben des Herstellers zur Erfüllung der Anforderungen an Sicherheit, Funktionstauglichkeit, Qualität, Datenschutz und Datensicherheit. Datenschutz und Datensicherheit digitaler Gesundheitsanwendungen (DiGA) haben für das BfArM höchste Priorität.
Der Nachweis der Erfüllung der Anforderungen der DiGAV zu Datenschutz und Datensicherheit als Voraussetzung für die Aufnahme in das DiGA-Verzeichnis des BfArM erfolgt nach den Vorgaben der DiGAV grundsätzlich durch die verbindliche Erklärung bzw. Beantwortung des Herstellers zu den Fragen der dortigen Anlage 1 und, soweit einschlägig, durch die Konformitätsbewertung und CE-Kennzeichnung im Rahmen des rechtmäßigen Inverkehrbringens als Medizinprodukt.
Bei der Antragsbewertung prüft das BfArM darüber hinaus ausgewählte Angaben der Selbstauskunft der Hersteller mit Hilfe des vom Hersteller zur Verfügung zu stellenden Zugangs zur App bzw. Webanwendung. Beispielsweise verwendet das BfArM Techniken, um unerlaubten Datenabfluss feststellen zu können und zu verifizieren, dass die Datenverarbeitung nur in zulässigen Ländern erfolgt.
Seit Inkrafttreten des Digitale-Versorgung-und-Pflege-Modernisierungs-Gesetzes (DVPMG) besteht zudem die Pflicht, dass für die aufzunehmende Applikationsversion (einschließlich aller Backend-Komponenten) Penetrationstests nach dem vom Bundesamt für Sicherheit in der Informationstechnik (BSI) empfohlenen Durchführungskonzept durchgeführt werden müssen. Auch die jeweils aktuellen OWASP Top-10 Sicherheitsrisiken sollen, wo anwendbar, berücksichtigt werden. Verpflichtende Bestandteile der Penetrationstests sind manuelle Code Reviews und ein Whitebox-Test. Der Test soll vorrangig von BSI-zertifizierten Teststellen durchgeführt werden. Bereits in der formalen Prüfphase müssen Nachweise über die Durchführung des Penetrationstests und die Behebung der dabei gefundenen Schwachstellen eingereicht werden. Diese Tests sind anforderungsbezogen zu wiederholen, z. B. wenn neue Schnittstellen in das Internet hinzukommen oder für externe Verbindungen relevante Bibliotheken aktualisiert werden. Des Weiteren muss der Hersteller der DiGA ein Informationssicherheitsmanagementsystem (ISMS) gemäß ISO 27001 oder gemäß ISO 27001 auf der Basis von IT-Grundschutz (BSI-Standard 200-2: IT-Grundschutz-Methodik) umgesetzt haben und dem BfArM seit dem 01.04.2022 ein entsprechendes Zertifikat vorweisen können.
Sofern dem BfArM Sicherheitsmängel bei ins Verzeichnis aufgenommenen DiGA bekannt werden, werden diese umgehend geprüft und eine Stellungnahme der Hersteller eingefordert. Der Hersteller muss dabei auf Basis der Anforderungen der DiGAV und der DSGVO fachlich fundiert darlegen, dass die Sicherheitsmängel unverzüglich behoben wurden und die DiGA somit vollumfänglich den Anforderungen an Datenschutz und Datensicherheit entspricht.
Unabhängig von der Prüfentscheidung des BfArM ist der Hersteller jederzeit verantwortlich für die Gewährleistung aller datenschutz- und datensicherheitsbezogenen sowie sonstigen rechtlichen Anforderungen an sein rechtmäßig in Verkehr befindliches Medizinprodukt, das ja eine zentrale Voraussetzung für eine DiGA darstellt. Deren Einhaltung bei der Nutzung der digitalen Anwendung gemäß dem aktuellen Stand der gesetzlichen und technischen Anforderungen sowie die wahrheitsgemäße Bestätigung der entsprechenden Einhaltung gegenüber dem BfArM im Rahmen des Antragsverfahrens liegen ebenfalls in der Verantwortung des Herstellers. Hierauf wurde u. a. in einem Webinar zum Thema Datenschutz und Datensicherheit noch einmal explizit hingewiesen.
Erweisen sich die im Antragsverfahren vorgelegten Angaben als unwahr oder nicht (mehr) den aktuellen Tatsachen entsprechend, wird unverzüglich geprüft, ob im Ergebnis die Sanktionsmaßnahmen gemäß § 139e Fünftes Buch Sozialgesetzbuch (SGB V) in Form der Streichung der DiGA aus dem Verzeichnis bzw. Zwangsgeld anzuwenden sind. Zudem hat der Hersteller dem BfArM gegenüber wesentliche Änderungen an der DiGA anzuzeigen; dies betrifft insbesondere auch solche, die sich auf Aspekte des Datenschutzes und der Datensicherheit beziehen.
In einem weiteren Schritt werden zukünftig die Datenschutz- und Datensicherheitsanforderungen im Rahmen von Zertifizierungsverfahren geprüft. Diese werden derzeit vorbereitet. Hierzu steht das BfArM im engen Austausch mit dem Bundesministerium für Gesundheit (BMG), dem Bundesamt für Sicherheit in der Informationstechnik (BSI) sowie der oder dem Bundesbeauftragten für den Datenschutz und die Informationsfreiheit (BfDI).
Datenverarbeitung außerhalb Deutschlands
Im Folgenden erläutert das BfArM seine aktuelle Rechtsauffassung in Bezug auf die Verarbeitung personenbezogener Daten außerhalb Deutschlands im Zusammenhang mit der Nutzung digitaler Gesundheitsanwendungen (DiGA).
Wir weisen darauf hin, dass derzeit u.a. auf europäischer Ebene sowie mit den Datenschutzbehörden weitere Abstimmungen zum Thema erfolgen und dies Auswirkungen auf die rechtliche Bewertung haben kann.
Eventuelle abweichende Vorgaben z.B. der Datenschutzbehörden können technische Anpassungen der DiGA mit diesbezüglicher Anzeigepflicht beim BfArM erforderlich machen, um die weitere Einhaltung der Vorgaben zum Datenschutz zu gewährleisten und eine eventuelle Streichung der DiGA aus dem Verzeichnis nach §139e SGB V zu vermeiden.
Schreiben der DiGA in die ePA/Implementierung der GesundheitsID
Die Nachweise zu der Erfüllung der Anforderungen „Schreiben der DiGA in die ePA“ [§ 6a Digitale Gesundheitsanwendungen-Verordnung (DiGAV), Anlage 2 Anforderung 5 DiGAV (Interoperabilität)] sowie „Implementierung der GesundheitsID“ [Anlage 1 Anforderung 15a DiGAV (Datensicherheit)] werden zu einem Schritt zusammengeführt. Das hierfür durchgeführte Bestätigungsverfahren der gematik nach § 327 Fünftes Buch Sozialgesetzbuch (SGB V) ist Anfang 2024 gestartet. Informationen zu dem Ablauf des Bestätigungsverfahrens (Verfahrensbeschreibung) und den nachzuweisenden Anforderungen (Anwendungssteckbrief) sind auf der Webseite der gematik zur Verfügung gestellt.
Nähere Informationen zu dem technischen Ablauf werden im TI-Leitfaden veröffentlicht:
TI-Leitfaden für DiGA-Hersteller
Um Herstellern ausreichend Zeit für die Umsetzung und Implementierung der Anforderungen sowie der Validierung zu gewähren, wurde folgender Übergangszeitraum festgelegt:
Für DiGA im laufenden Antragsverfahren und für neu zu stellende DiGA-Anträge gilt:
Bis 30.04.2024: Der Hersteller muss das Bestätigungsverfahren der gematik für die Nutzung von Komponenten bzw. Produkten der Telematikinfrastruktur (TI) erfolgreich durchlaufen haben und die Bestätigung beim BfArM einreichen.
Ab 01.05.2024: Die Vorlage dieser Bestätigung ist Voraussetzung für die formale Vollständigkeit. Des Weiteren muss in einem gesonderten Dokument beschrieben werden, in welcher Art und Weise die Datenübermittlung in die elektronische Patientenakte (ePA) stattfindet, einschließlich der Information, in welchen zeitlichen Abständen diese Daten übermittelt werden.
Nach Aufnahme in das DiGA-Verzeichnis: Der Hersteller benachrichtigt das BfArM innerhalb von 6 Wochen nach Zustellung des Genehmigungsbescheids über die Aktivierung der SMC-B sowie die erfolgreiche IDP-Registrierung (Identity Provider). Sollte es hier zu Verzögerungen im Ablauf kommen, sind diese dem BfArM mitzuteilen.
Für bereits gelistete DiGA im Verzeichnis gilt:
Der Hersteller muss das Bestätigungsverfahren der gematik für die Nutzung von Komponenten bzw. Produkten der TI bis spätestens zum 30.04.2024 erfolgreich durchlaufen haben. Zum Nachweis der Erfüllung der Anforderungen, das Schreiben in die ePA sowie eine Authentifizierung über die GesundheitsID zu ermöglichen, ist die Anzeige einer wesentlichen Veränderung erforderlich. Hersteller, die keine Anzeige einer wesentlichen Veränderung eingereicht haben, werden ab dem 01.05.2024 durch das BfArM hierzu aufgefordert. Voraussetzungen für die formale Vollständigkeit der Anzeige sind das erfolgreiche Durchlaufen des Bestätigungsverfahrens und die Einreichung des Registrierungsantrags (Kontaktdaten, DiGA-Name, Angaben zum Verfahrensschlüssel etc.) sowie des PU-Registrierungsantrags (Produktiv-Umgebung; enthält Angaben zu „Scopes“ etc.). Hierbei gilt es zu beachten, dass die Angaben im Bescheid über das erfolgreiche Durchlaufen des Bestätigungsverfahrens mit den Angaben im PU-Registrierungsantrag konsistent sein müssen. Die enthaltenden Informationen müssen zudem deckungsgleich mit den Inhalten des Entity Statements sein. Dies sollte vor der Einreichung beim BfArM noch einmal genau überprüft und falls abweichend korrigiert werden. Der PU-Registrierungsantrag muss zudem als XML-Datei oder Originaldatei mit voller Funktionalität aller Elemente vorliegen. Das BfArM leitet den PU-Registrierungsantrag (XML) sowie den Registrierungsantrag mit den Kontaktdaten (PDF) an die gematik weiter. Des Weiteren müssen in der Anzeige einer wesentlichen Veränderung die Anpassungen im Bereich Datenschutz/Datensicherheit sowie im Bereich Funktionsweise, insbesondere in welcher Art und Weise und welchen zeitlichen Abständen die Datenübermittlung in die ePA stattfindet, beschrieben werden. Gemäß der Anforderung 5 Anlage 2 DiGAV ist eine manuelle und eine regelmäßige, automatisiere Übermittlung anzubieten (siehe unten).
Hinweise zu erlaubten „Scopes“
Innerhalb des PU-Registrierungsantrags zur Registrierung der DiGA in der TI-Föderation (Federation Master) werden verschiedene Scopes abgefragt, die der Datenabfrage der DiGA bei den entsprechenden IDP entsprechen. An verschiedenen Stellen sind hier personenbezogene Daten hinterlegt, die eine persönliche Identifizierung der Nutzenden ermöglichen. Eine Abfrage dieser Daten ist nicht mit den Anforderungen an den Datenschutz gemäß § 4 und der Anlage 1 DiGAV sowie den Datenschutzkriterien nach § 139e Absatz 11 SGB V und § 78a Absatz 8 Elftes Buch Sozialgesetzbuch (SGB XI) vereinbar und muss daher unterbleiben. Die einzige Ausnahme bildet die derzeit systembedingt noch erforderliche Abfrage der Krankenversichertennummer (KVNR). Konkret handelt es sich hierbei um die Scopes E-Mail, Anzeigename, Vorname und/oder Nachname. Sollte die DiGA diese Daten standardmäßig abfragen, ist eine Anpassung der Anwendung erforderlich. Dies sollte keine funktionalen Beeinträchtigungen der DiGA verursachen, da eine eindeutige Identifikation auch durch ein personen- und anwendungsspezifisches Pseudonym möglich ist, das bei jeder erfolgreichen Abfrage am IDP übermittelt wird. Eine optionale Abfrage der E-Mail-Adresse ist möglich, sofern Nutzende zuvor gefragt werden, ob sie mit der Abfrage der hinterlegten E-Mail-Adresse einverstanden sind. Mit der Einholung des Einverständnisses der Nutzenden sollte zugleich auch eine Empfehlung zur Nutzung einer pseudonymen E-Mail-Adresse verbunden sein. Die Nutzenden müssen zudem jederzeit die Möglichkeit haben, eine nachträgliche Änderung ihrer E-Mail-Adresse durchzuführen. Ein Abfrage der Scopes Anzeigename, Vorname und/oder Nachname ist nicht erlaubt. Sollten die Scopes Alter, Geschlecht und/oder Geburtsdatum standardmäßig abgefragt werden, muss eine plausible Rechtfertigung gegeben werden können, inwiefern diese Daten zur Nutzung der DiGA erforderlich sind.
Hinweis: Eine Weitergabe des Registrierungsantrags an die gematik erfolgt bei Anträgen auf Aufnahme in das DiGA-Verzeichnis erst nach erfolgter Aufnahme in das DiGA-Verzeichnis.
Hinweise zur Implementierung und dem Testzugang
Hinsichtlich der Datenübertragung in die ePA wird auf das Folgende hingewiesen: Die Anforderung 5 Anlage 2 der DiGAV sieht vor, dass jederzeit eine manuelle Datenübermittlung seitens versicherter Personen gestartet werden kann und die Möglichkeit einer regelmäßigen, automatisierten Übermittlung durch die DiGA gegeben sein muss. Dies schließt die Möglichkeit ein, die automatisierte Übermittlung bei Bedarf zu deaktivieren und eine manuelle Übertragung zu nutzen. Somit müssen den Nutzenden immer beide Optionen (manuelle und regelmäßige, automatisiere Übermittlung) zur Verfügung gestellt werden.
Für den Test der Funktionalitäten seitens des BfArM wird gebeten, die Verwendung der Authenticator-App der gematik in Verbindung mit der DiGA zu ermöglichen. Des Weiteren müssen in der dem BfArM zur Verfügung gestellten (Test-)Version alle geforderten Informationstexte und Funktionalitäten (siehe beispielsweise vorheriger Abschnitt) sichtbar sein. Es wird dem BfArM nach derzeitigem Stand allerdings nicht möglich sein, alle Use Cases in die Prüfung einzubeziehen. In diesen Fällen muss bestätigt bzw. belegt werden, dass die Funktionalität entsprechend der Vorgaben umgesetzt wurde.
Der Hersteller muss dem BfArM bestätigen, dass die zur Verfügung gestellte Testversion hinsichtlich der Implementierungen zur GesundheitsID und dem Schreiben in die ePA inklusive der Darstellungsweise der Menüs mit der Version für die Produktivumgebung übereinstimmt.
Live-Schaltung der neuen ePA/GesundheitsID-Funktionalitäten
Nach erfolgreicher Prüfung der Funktionalitäten in der Referenzumgebung durch das BfArM (s. o.) und Genehmigung der Anzeige einer wesentlichen Veränderung bzw. des Antrags auf Aufnahme in das DiGA-Verzeichnis hat eine Live-Schaltung der Funktionalitäten zur Anbindung an die ePA sowie zur Authentisierung über die GesundheitsID in der Produktivumgebung zu erfolgen. Diese muss spätestens dann unverzüglich erfolgen, wenn die Integrationstests in der Referenzumgebung gegen die zugelassenen sektoralen IDP erfolgreich abgeschlossen worden sind. Die Mitteilung der Live-Schaltung hat unter Angabe der unterstützten Release-Version der ePA per E-Mail an diga@bfarm.de zu erfolgen. In diesem Rahmen soll eine entsprechende Ergänzung des Felds „Möglichkeiten von standardisiertem Datenimport und Datenexport“ im DiGA-Verzeichnis erfolgen.
Wechsel auf die neue Release-Version 3.0 der ePA
Für diejenigen DiGA, für die die Implementierung der Funktionalitäten hinsichtlich der GesundheitsID und der ePA in der Release-Version 2.6 gemäß der oben beschriebenen Vorgaben durchgeführt wurde, muss der Wechsel auf die Release-Version 3.0 per E-Mail an diga@bfarm.de mitgeteilt werden. Neben der Anzeige der Verzeichnisänderung (Anpassung auf die Version 3.0) muss hierbei bestätigt werden, dass sich durch die Umstellung am Erscheinungsbild/der Nutzerführung für die Versicherten nichts geändert hat, sowie in der Referenzumgebung der gematik die Anbindung an die ePA 3.0 erfolgreich war und entsprechende Nachweise auf Verlangen vorgelegt werden können.Für diejenigen DiGA, für die noch keine Funktionalitäten hinsichtlich der GesundheitsID und der ePA in der Release-Version 2.6 implementiert wurden, müssen die oben genannten Schritte (siehe u. a. „Hinweise zur Implementierung und dem Testzugang“) für die Release-Version 3.0 im Antragsverfahren zur Aufnahme in das DiGA-Verzeichnis bzw. im Falle einer bereits im DiGA-Verzeichnis gelisteten DiGA im Rahmen einer Anzeige einer wesentlichen Veränderung durchgeführt werden.
Template zur Erfassung der von der DiGA verarbeiteten Daten nach § 2 Abs. 1 Nr. 21a DiGAV
Aus der DiGAV-Änderungsverordnung, die am 1. Oktober 2021 in Kraft getreten ist, geht die Anforderung hervor, dass nach § 2 Abs. 1 Nr. 21a DiGAV alle DiGA-Hersteller, auch solche, deren Produkte bereits im Verzeichnis gelistet sind, eine vollständige tabellarische Übersicht über die in der DiGA enthaltenen Daten einreichen müssen. Die Übersicht wird im DiGA-Verzeichnis veröffentlicht. Zudem müssen die Hersteller ab dem 1. August 2022 bei der Entwicklung die syntaktischen und semantischen Festlegungen der Kassenärztliche Bundesvereinigung (KBV) nach § 355 Abs. 2a SGB V (Medizinisches Informationsobjekt, MIO "DiGA Toolkit") berücksichtigen, um einen Export der Daten in die elektronische Patientenakte zu ermöglichen. Die finale Fassung des MIO DiGA Toolkits wird von der KBV spätestens bis zum 30. Juni 2022 veröffentlicht.
Nach § 6a Abs. 2 DiGAV muss ab dem 1. Januar 2023 ein entsprechend standardisierter Datenexport aus der DiGA implementiert sein. Auch bereits gelistete DiGA müssen einen Datenexport gemäß MIO DiGA Toolkit bis zum 1. Januar 2023 umsetzen. Das MIO DiGA Toolkit wird von der KBV regelmäßig fortgeschrieben. Damit werden auch Daten, die zunächst noch nicht abgebildet sind, perspektivisch von der Standardisierung erfasst. Für die Weiterentwicklung des MIO DiGA Toolkits werden die eingereichten Daten dieser Tabelle berücksichtigt.
Anhand des hier verlinkten Templates müssen ab sofort alle Datenelemente, die im Rahmen des bestimmungsgemäßen Gebrauchs der DiGA verarbeitet werden, aufgeführt und erläutert werden, ab dem 1. August 2022 zudem unter Berücksichtigung des MIO DiGA Toolkits. Das ausgefüllte Template kann zukünftig über das elektronische Antragsportal im Rahmen des Antragsverfahrens in PDF-Form hochgeladen werden. Bis dahin bitten wir Sie, das ausgefüllte Excel-Template im Rahmen des Antragsverfahrens per E-Mail an diga@bfarm.de zu senden. Gleiches gilt für Hersteller von bereits im DiGA-Verzeichnis gelisteten DiGA.
FHIR-Validator zur Überprüfung der Anforderungen an die Interoperabilität gemäß DiGAV
Gemäß Anforderung 1 Interoperabilität der Anlage 2 der Digitale Gesundheitsanwendungen-Verordnung (DiGAV) muss die oder der Versicherte die über DiGA verarbeiteten Daten in einem interoperablen Format aus der DiGA exportieren können. Die Übermittlung soll gemäß der Festlegung für die semantische und syntaktische Interoperabilität von Daten der elektronischen Patientenakte nach § 355 Absatz 2a des Fünften Buches Sozialgesetzbuch (MIO DiGA Toolkit) erfolgen. Um überprüfen zu können, ob der Datenexport einer DiGA konform mit dem MIO DiGA Toolkit ist, steht im DiGA-Antragsportal des BfArM nach dem Anlegen einer DiGA unter dem Reiter „Tools“ ein FHIR-Validator zur Verfügung.
Die Nutzung des FHIR-Validators ist zum jetzigen Zeitpunkt freiwillig. Feedback hierzu oder Probleme in der Handhabung können gerne per E-Mail an diga@bfarm.de gesendet werden. Der Zeitpunkt der verpflichtenden Nutzung des FHIR-Validators zur Erfüllung der Anforderung 1 Interoperabilität der Anlage 2 DiGAV wird mit einer entsprechenden Vorlaufzeit angekündigt werden.
Weitere Informationen zur Nutzung des FHIR-Validators finden Sie in der nachfolgenden Kurzanleitung.
Unterstützung/Beratung durch das BfArM
Das BfArM berät zu den Voraussetzungen der Aufnahme in das DiGA-Verzeichnis, um eine umfassende Betreuung der Antragsteller zu gewährleisten und sie frühzeitig dabei zu unterstützen, aussagekräftige Unterlagen und Daten für eine (endgültige) Aufnahme in das Verzeichnis zu erstellen. In einem Kick-off Meeting können dabei Fragen erörtert werden, die sich zu individuellen Produkten über die Erläuterungen im Leitfaden hinaus auf Seiten der Antragsteller ergeben. Darüber hinaus berät das BfArM zu verfahrenstechnischen Fragen sowie zu Fragen rund um die Anzeige wesentlicher Änderungen einer DiGA.
Aus Gründen der Planbarkeit finden die Beratungen zum Fast-Track-Verfahren vorerst mittwochs und donnerstags nachmittags (außer im Falle eines Feiertags) in der Zeit zwischen 13 und 16 Uhr statt. Bitte geben Sie Ihre Terminwünsche unter Berücksichtigung dieser Slots bei der Beantragung eines Kick-off Meetings zum Fast-Track-Verfahren entsprechend an. Anfragen werden in der eingehenden Reihenfolge bearbeitet. Das ausgefüllte Antragsformular zusammen mit den Terminwünschen senden Sie bitte an: innovation@bfarm.de
Der Leitfaden des BfArM zum Fast-Track-Verfahren: Transparenter Überblick zum Verfahren und Interpretationshilfe zu den Anforderungen
Mit einem Leitfaden bietet das BfArM eine zusammenfassende Darstellung der Regelungen, die an verschiedenen Stellen im SGB V, in der DiGAV und in den Anlagen zur DiGAV zu finden sind. Das BfArM legt in dem Leitfaden dar, wie es die normativen Vorgaben aus DVG und DiGAV regelmäßig auslegen wird. Es schafft damit Transparenz zu den konkret zu erfüllenden Anforderungen im Verfahren. Der Leitfaden ist somit für Antragsteller und BfArM eine verlässliche Handlungsgrundlage. Gleichzeitig ist der Leitfaden aber auch so konzipiert, dass alle Interessierten sich ein umfassendes Bild von den Bewertungsgrundlagen und folglich von den (Qualitäts-)Eigenschaften einer DiGA machen können. Er wird auf Basis der gesammelten Erfahrungen kontinuierlich angepasst, ergänzt und weiterentwickelt.
Hinweise zu Ergänzungen, Präzisierungen etc. nehmen wir gerne unter leitfaden@bfarm.de oder diga@bfarm.de . entgegen.
Das Antragsverfahren und das elektronische Antragsportal
Hier kommen Sie zum Antragsportal des BfArM zum Fast-Track-Verfahren nach § 139e SGB V für digitale Gesundheitsanwendungen (DiGA). Bitte beachten Sie, dass sämtliche Anträge und Anzeigen ausschließlich elektronisch über dieses Portal eingereicht werden können, eine Zusendung per E-Mail oder Post ist nicht möglich.
Ziel des elektronischen Portals ist es, Ihnen die einfache Verwaltung Ihrer entsprechenden Anträge und Anzeigen an das BfArM zu ermöglichen und Sie bestmöglich bei der Einreichung zu unterstützen. Hierzu stehen Ihnen bei den einzelnen Fragen und Anforderungen der entsprechenden Anträge und Anzeigen ausführliche Fragebeschreibungen zur Verfügung, in denen erläutert wird, welche Informationen oder Unterlagen eingefordert werden.
So sollen Hersteller der DiGA bei der effizienten Einreichung vollständiger und formal korrekter Anträge unterstützt werden.
Hinweis: Für die Nutzung des DiGA-/DiPA-Antragsportals ist es erforderlich, einmalig eine Identifizierung mit einem digitalen Zertifikat durchzuführen. Nähere Informationen finden Sie in der Anleitung „Authentifizierung im DiGA-/DiPA-Antragsportal über Zertifikate“.
In diesem Zusammenhang freuen wir uns über Ihr Feedback zur Nutzungsfreundlichkeit des Portals sowie zu Hinweisen auf eventuelle Probleme und Verbesserungsmöglichkeiten unter der E-Mail-Adresse diga@bfarm.de .
Das DiGA-Verzeichnis
In diesem Verzeichnis werden für DiGA-Nutzer wie auch für Ärzte und Psychotherapeuten wesentliche Informationen zu den DiGA zusammenfassend dargestellt, die alle Anforderungen erfüllt und das Bewertungsverfahren des BfArM erfolgreich durchlaufen haben. Dies sorgt für umfangreiche Transparenz, damit gut informierte Entscheidungen getroffen werden können und eine vertrauensvolle Nutzung möglich wird.
Zu den Angaben im Verzeichnis zählen neben allgemeinen Informationen wie Produktname, Hersteller etc. Angaben zu den positiven Versorgungseffekten, also dazu, wie sich der gesundheitliche Zustand eines Patienten oder seine Möglichkeiten zum Umgang mit seiner Erkrankung durch die Benutzung der DiGA verbessern, zudem Hinweise für die Verschreibung und Erstattung dieser DiGA.
Hier gelangen Sie zum DiGA-Verzeichnis.
Anzeige wesentlicher Veränderungen von DiGA
Wesentliche Veränderungen
Änderungen an der DiGA, die wesentlichen Einfluss auf die Bewertungsentscheidung des BfArM haben oder zu Änderungen der Angaben im Verzeichnis führen können, sind gemäß § 18 der Digitalen Gesundheitsanwendungen-Verordnung (DiGAV) „wesentliche Veränderungen“ an der DiGA und dem BfArM gegenüber als solche über das entsprechende Formular im Antragsportal anzuzeigen. Eine wesentliche Veränderung kann z. B. eine Änderung des Orts der Datenspeicherung, eine Änderung der Systemanforderungen etc. sein. Das BfArM weist in diesem Zusammenhang ausdrücklich darauf hin, dass auch solche Veränderungen als wesentlich anzusehen sind, die vom Hersteller ausschließlich zur Wiederherstellung eines DiGAV-konformen Zustandes vorgenommen wurden oder werden, also z.B. unverzügliche eigenverantwortliche Anpassungen nach Bekanntwerden eines Datenschutz- oder Datensicherheitsmangels, korrektive Maßnahmen am Medizinprodukt nach Medizinprodukte-Sicherheitsplanverordnung (MPSV) oder Anpassungen auf Basis neuer Erkenntnisse mit negativen Auswirkungen auf den positiven Versorgungseffekt. Wir empfehlen die unverzügliche Kontaktaufnahme mit dem BfArM unter diga@bfarm.de , sobald Ihnen als Hersteller Informationen zu möglichen Risiken oder Schwachstellen Ihrer DiGA bekannt werden, die den o.g. Kategorien unterfallen und somit eine weitere Listung im Verzeichnis gefährden könnten.
Selbsteinschätzung und Verfahren
Zur Selbsteinschätzung seitens des Herstellers, ob eine Veränderung an der DiGA eine „wesentliche Veränderung“ im Sinne des § 18 DiGAV ist, hat das BfArM untenstehenden Prüfbogen zur Verfügung gestellt. Sobald wenigstens eine der dort gelisteten Fragen mit „Ja“ beantwortet wird, ist davon auszugehen, dass die geplante Änderung unter das Merkmal einer anzeigepflichtigen wesentlichen Änderung fällt. Der Prüfbogen soll jedoch lediglich zur Unterstützung der Einschätzung des Herstellers dienen und entbindet diesen ausdrücklich nicht von seiner Verantwortung zur Entscheidung über eine eventuelle Anzeige nach den Vorgaben der DiGAV. Im Zweifelsfall wird empfohlen, das BfArM zu einer (geplanten) Änderung zu konsultieren.
Die Änderungsanzeige zu wesentlichen Veränderungen ist im Antragsportal zu stellen. Sofern sich im Laufe der Bewertung der Änderungsanzeige durch das BfArM herausstellt, dass die Angaben der Anzeige nicht ausreichen, um über die Erforderlichkeit der Anpassung des Verzeichnisses oder über die Streichung der Anwendung aus dem Verzeichnis zu entscheiden, kann das BfArM den Hersteller einmalig auffordern, die Angaben innerhalb einer Frist von bis zu drei Monaten zu ergänzen.
Die Anzeige beim BfArM und dessen nachfolgende Prüfung hinsichtlich möglicher Konsequenzen für die weitere Listung im DiGA-Verzeichnis entbindet den Hersteller nicht von seiner Verpflichtung, etwaige ihm bekanntwerdende Risiken bzw. Mängel z.B. zu Datenschutzaspekten und zur Sicherheit des Medizinproduktes unverzüglich nach den einschlägigen rechtlichen Vorgaben (z.B. DSGVO, MPSV, DiGAV) zu bewerten und zu behandeln.
Mögliche Folgen einer Nichtanzeige
Erlangt das BfArM Kenntnis von nicht angezeigten wesentlichen Veränderungen einer DiGA, so hat es dem jeweiligen Hersteller gemäß § 139e SGB V Abs. 6 eine Frist zur Anzeige zu setzen, die in der Regel nicht mehr als vier Wochen betragen darf. Das BfArM kann dem Hersteller gleichzeitig ein Zwangsgeld von bis zu 100.000,- Euro androhen und dieses Zwangsgeld im Falle der Nichteinhaltung der Frist zur Anzeige festsetzen. Kommt der Hersteller der Aufforderung zur Anzeige wesentlicher Veränderungen nicht innerhalb der gesetzten Frist nach, kann das BfArM die DiGA aus dem Verzeichnis streichen.
Die Anzeige und Bewertung der wesentlichen Änderung(en) kann dazu führen, dass das BfArM die Angaben zu der DiGA im Verzeichnis anpasst. Auch kann die Bewertung der vorgenommenen Änderung(en) zu der Entscheidung führen, dass die Anforderungen zur Aufnahme in das Verzeichnis durch die Umsetzung der Änderungen nicht mehr erfüllt sind. Das BfArM entscheidet damit nicht über die Umsetzung der entsprechenden wesentlichen Änderung, sondern über die Frage, ob die Umsetzung ggfs. Auswirkungen auf die weitere Listung im Verzeichnis hat.
Um in einem solchen Fall eine Streichung aus dem Verzeichnis zu vermeiden, wird empfohlen, frühzeitig Kontakt mit dem BfArM aufzunehmen und ggf. Abstand von der geplanten Änderung zu nehmen bzw. diese entsprechend den Empfehlungen des BfArM in angepasster Form durchzuführen.
Informationen zur Bereitstellung verordnungsrelevanter Daten
Wesentliches identifizierendes Merkmal einer DiGA für die Verordnung ist die Pharmazentralnummer, die auf Basis unterschiedlicher Verordnungseinheiten der DiGA vom BfArM zugewiesen wird:
Verordnungseinheit einer DiGA
Zu einer DiGA kann es unterschiedliche Verordnungseinheiten geben, analog z.B. verschiedenen Dosierungen und Packungsgrößen bei Arzneimitteln, die der Arzt oder Psychotherapeut dem Patienten verordnen kann. Jede Verordnungseinheit wird mit einer eigenen Kennnummer versehen und kann entsprechend spezifisch verordnet werden. Die einzelnen Verordnungseinheiten können je nach Ausgestaltung der DiGA variieren und sich z.B. hinsichtlich der folgenden Merkmale unterscheiden:
- Ist in der Verordnung Hardware (z.B. Pulsmesser, EKG-Sensorik) eingeschlossen?
- Handelt es sich um ein Startpaket mit einmaligem zusätzlichem Aufwand (z.B. einmalige besondere Datenerhebung zu Beginn oder einmalige Installation besonderer Hardware) oder um eine Fortführung einer bereits begonnenen Anwendung (z.B. Anwendung für weitere 30 Tage)?
- Für welche Anwendungsdauer (z.B. 30, 60, 90 Tage) wird die DiGA verordnet?
- Sofern eine DiGA unterschiedliche Module umfasst: Welches Modul soll verordnet werden (z.B. „Gelenkfit - Modul Knie“, „Gelenkfit - Modul Schulter“)?
DiGA-ID und DiGA-Verordnungseinheit-ID im Verzeichnis
Gemäß § 20 Abs. 1 der Digitale Gesundheitsanwendungen-Verordnung (DiGAV) vergibt das BfArM für jede ins Verzeichnis nach § 139e SGB V aufgenommene DiGA eine eineindeutige Verzeichnisnummer, die diese innerhalb des Verzeichnisses identifiziert und damit die Referenz zum Verzeichniseintrag darstellt.
Entsprechend wird jeder DiGA (z.B. DiGA „Gelenkfit“) bei Aufnahme in das Verzeichnis eine 5-stellige numerische DiGA-ID zugeordnet (z.B. 12345).
Zur eineindeutigen Kennzeichnung unterschiedlicher Verordnungseinheiten derselben DiGA im Verzeichnis erhält jede Verordnungseinheit eine 8-stellige numerische DiGA-Verordnungseinheit-ID (DiGA-VE-ID), die sich aus der 5-stelligen DiGA-ID und einer sich unmittelbar anschließenden fortlaufenden 3-stelligen Verordnungseinheit-Nummerierung zusammensetzt (z.B. „Gelenkfit - Modul Knie - Verordnung für 30 Tage“: 12345001, „Gelenkfit - Modul Knie - Verordnung für 60 Tage“: 12345002“, „Gelenkfit - Modul Schulter - Verordnung für 30 Tage“: 12345003).
Damit ist aus der DiGA-VE-ID erkennbar, dass es sich um eine bestimmte Verordnungseinheit (letzte drei Stellen) einer bestimmten, im Verzeichnis gelisteten DiGA (erste fünf Stellen) handelt.
Pharmazentralnummer (PZN)
Zur Verordnung der DiGA und ihrer spezifischen Verordnungseinheiten durch Arzt oder Psychotherapeut wird jeder DiGA-Verordnungseinheit bei der Aufnahme ins Verzeichnis zusätzlich eine eineindeutige 8-stellige numerische Pharmazentralnummer (PZN) zugeordnet, eine Nummer, die den etablierten Standard zur Identifizierung z.B. unterschiedlicher Dosierungen und Packungsgrößen bei Arzneimitteln darstellt und dementsprechend bereits in allen Praxisverwaltungssystemen (PVS) implementiert ist.
Die PZN wird zentral von der Informationsstelle für Arzneimittelspezialitäten - IFA GmbH vergeben, die dem BfArM die benötigten PZN zur Zuordnung zu den DiGA-Verordnungseinheiten zur Verfügung stellt, sodass diese zusätzlich zur DiGA-VE-ID im Verzeichnis nach §139e SGB V gelistet werden.
Unabhängig vom Verfahren der Datenübertragung in die Praxisverwaltungssysteme (PVS) stellt die PZN damit die für die Verordnung von DiGA relevante Kennnummer dar und DiGA bzw. ihre einzelnen Verordnungseinheiten können unter Nutzung der im Verzeichnis nach § 139e SGB V gelisteten und sukzessive in den PVS angezeigten PZN verordnet werden, indem sie auf dem entsprechenden Rezeptvordruck (Muster 16) eingedruckt oder manuell vermerkt werden.
Verfahren zur Bereitstellung verordnungsrelevanter Daten durch das BfArM
Gemäß §20 Abs. 1 DiGAV listet das BfArM in seinem Verzeichnis nach §139e SGB V die nach §33a Abs. 1 SGB V in der gesetzlichen Krankenversicherung erstattungsfähigen DiGA. Die Listung im Verzeichnis umfasst dabei sowohl die DiGA-ID und die DiGA-VE-ID, als auch die PZN. Zur unmittelbaren elektronischen Bereitstellung der verordnungsrelevanten Daten für die PVS arbeitet das BfArM bereits intensiv an der Entwicklung einer entsprechenden Schnittstelle. Bis diese Schnittstelle zur Verfügung steht und auch seitens der PVS-Hersteller in ihre Software implementiert wurde, wird der etablierte Datenlieferweg über die IFA genutzt. Entsprechend liefert das BfArM bei Neuaufnahme oder Änderung eines Eintrags in das Verzeichnis unmittelbar einen entsprechenden Datensatz an die IFA, die diesen dann für die Nutzung in PVS bereitstellt, sodass die DiGA verordnenden Ärzten und Psychotherapeuten dort zur Auswahl und Verordnung zur Verfügung stehen.
Um die schnellstmögliche Bereitstellung zu erreichen und entsprechend Programmieraufwand bei IFA und PVS-Herstellern zu vermeiden, werden ausschließlich auch bei Arznei- und Hilfsmitteln verwendete und damit bereits in den PVS implementierte Datenfelder genutzt. Eine Übersicht der entsprechend vom BfArM an die Informationsstelle für Arzneimittelspezialitäten - IFA GmbH übermittelten Datenfelder einschließlich eines erläuternden Beispiels finden Sie in dieser Tabelle. Da die Bereitstellung der PZN von der IFA direkt an das BfArM und nicht an den Hersteller der jeweiligen DiGA erfolgt, ist das BfArM hier in der IFA-Systematik als „Anbieter“ gelistet.
Sobald die direkte Schnittstelle zur Verfügung steht, wird das BfArM darüber informieren und es erfolgt in Abstimmung mit den beteiligten Institutionen und Verbänden der Wechsel des Datenübertragungsverfahrens. Die PZN bleibt auch danach identifizierendes Merkmal für die Verordnung.
Zahlen und Fakten rund um das DiGA-Verzeichnis
Hier finden Sie zweiwöchentlich aktualisierte Zahlen und Fakten rund um das DiGA-Verzeichnis und den DiGA-Fast-Track des BfArM. Sie können z.B. sehen, wie viele Anträge das BfArM zur vorläufigen oder endgültigen Aufnahme ins DiGA-Verzeichnis erhalten hat und wie viele Antragsverfahren bereits abgeschlossen wurden, z.B. durch entsprechende Aufnahme ins DiGA-Verzeichnis.
Wir bitten um Verständnis, dass wir aus Datenschutzgründen leider keine Auskunft zu Antragsdetails geben können, also z.B. dazu, welche Hersteller Anträge gestellt haben oder auf welche DiGA sie sich beziehen. Alle Informationen zu den DiGA, die das Prüfverfahren des BfArM erfolgreich durchlaufen haben, finden Sie im DiGA-Verzeichnis.
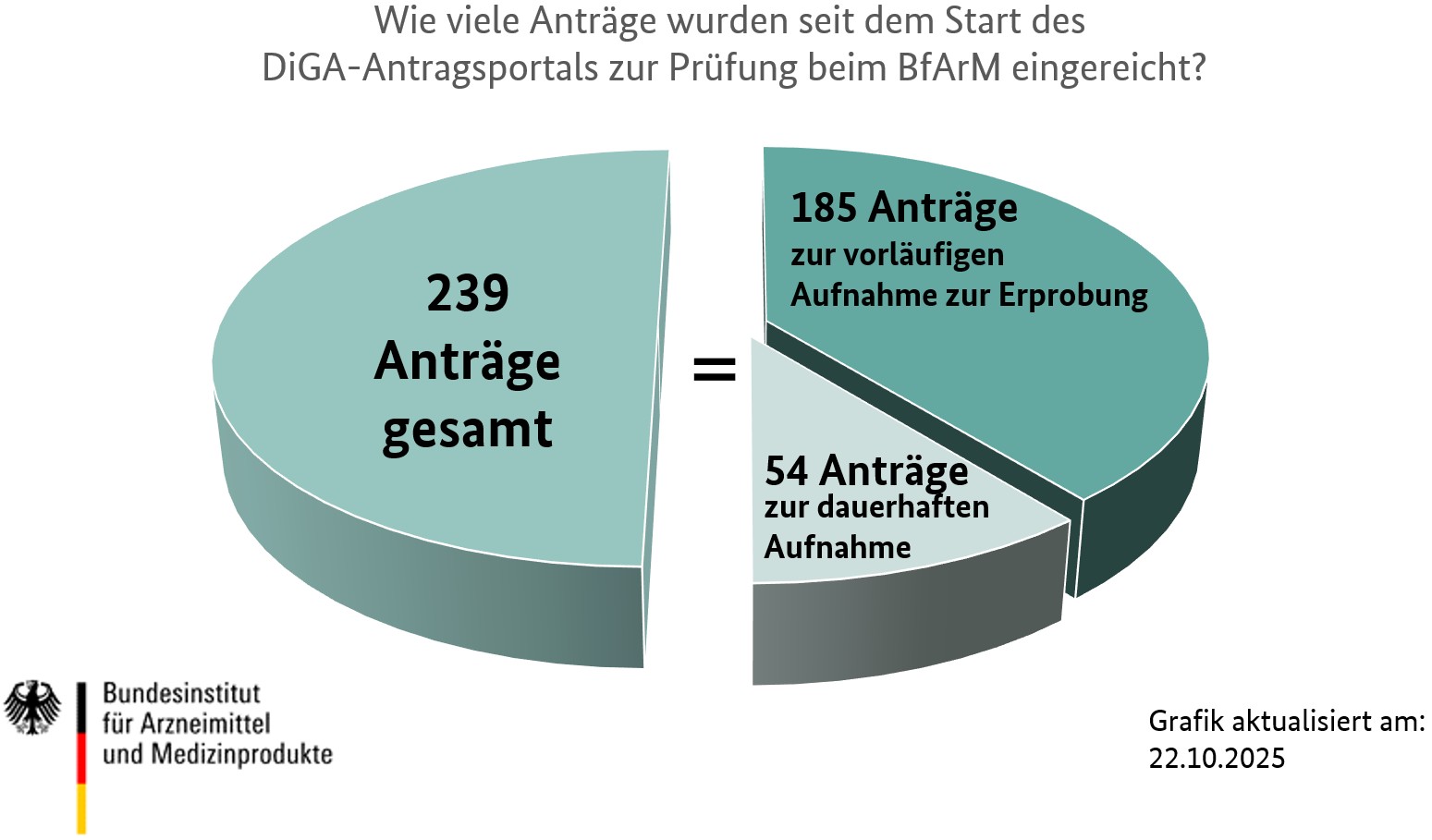
Die Grafik gibt einen Überblick, wie viele Anträge zur Aufnahme in das DiGA-Verzeichnis seit dem Beginn des Verfahrens am 27. Mai 2020 beim BfArM eingereicht wurden. Außerdem können Sie sehen, wie viele dieser Anträge direkt zur dauerhaften Aufnahme in das Verzeichnis gestellt wurden und wie viele zunächst zur vorläufigen „Aufnahme zur Erprobung“. Die Entscheidung, welche Antragsart beim BfArM eingereicht wird, trifft der Hersteller bzw. Antragsteller. Weitere Informationen und Erläuterungen zu diesem Thema finden Sie hier auf der Webseite sowie in unserem Leitfaden.
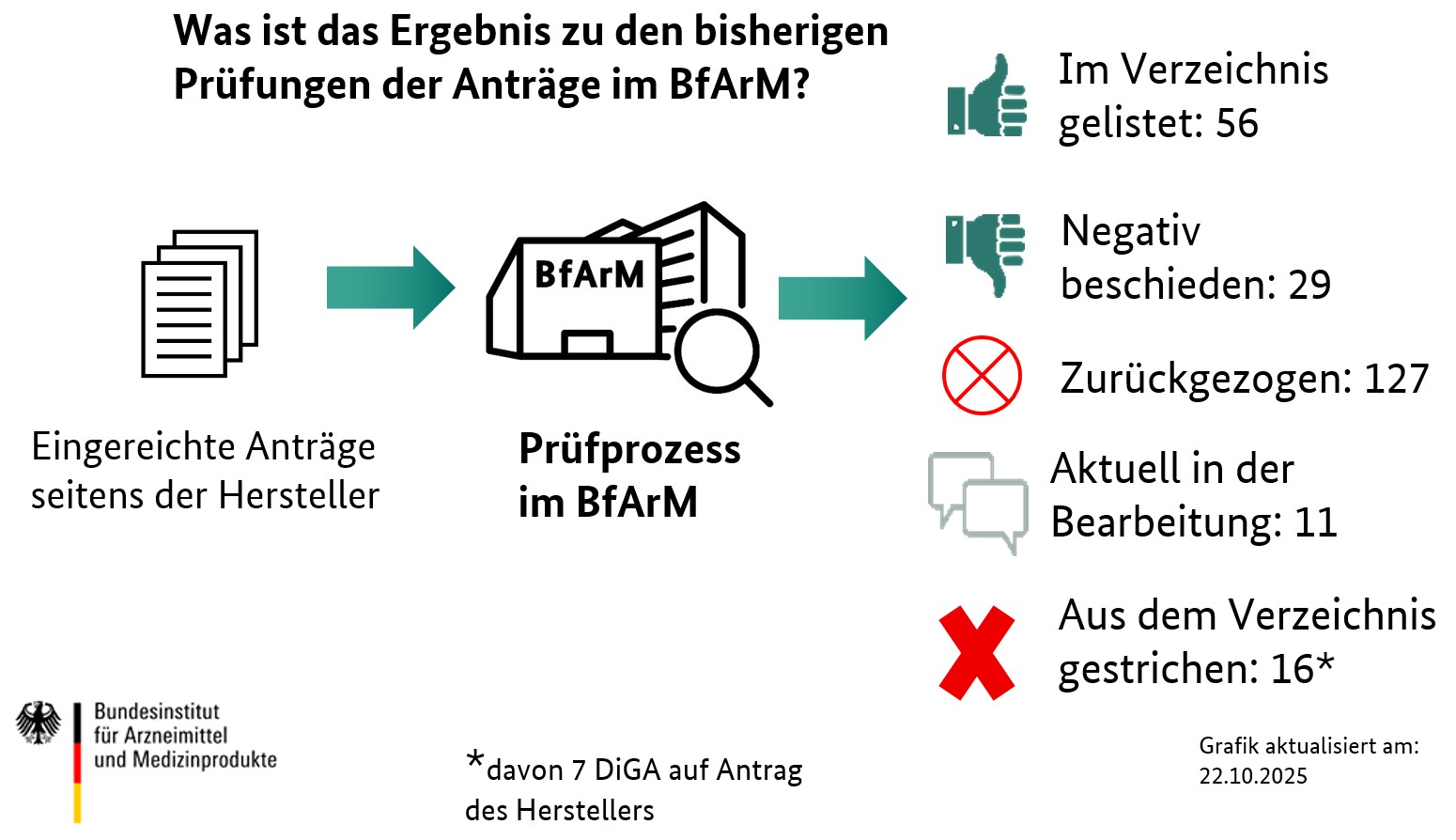
In der nachfolgenden Grafik informieren wir über die Ergebnisse zu den Prüfungen der Anträge im DiGA-Fast-Track des BfArM. „Positiv beschieden“ bedeutet, dass die vom Hersteller im Antrag genannte DiGA in das DiGA-Verzeichnis aufgenommen wurde – je nach Antragsziel entweder vorläufig zur Erprobung oder endgültig. „Negativ beschieden“ heißt dagegen, dass die DiGA im Ergebnis der Prüfung durch das BfArM nicht in das Verzeichnis aufgenommen werden konnte, da nicht alle Kriterien dafür erfüllt waren. Die Zahl bei „Zurückgezogen“ drückt aus, wie viele Anträge während der Prüfung des BfArM durch den Antragsteller zurückgezogen wurden, so dass der Prüfprozess nicht bis zum Ende durchgeführt werden konnte. Mit „Aktuell in der Bearbeitung“ möchten wir darstellen, wie viele Anträge gerade im BfArM bearbeitet werden.
Schnittstelle zum DiGA-Verzeichnis
Gemäß § 21 Absatz 2 und 3 der Digitale Gesundheitsanwendungen-Verordnung (DiGAV) stellt das BfArM berechtigten Nutzerinnen und Nutzern die im DiGA-Verzeichnis veröffentlichten Daten auf Antrag in maschinenlesbarer Form zur Verfügung. Diese Daten werden über eine Programmierschnittstelle (DiGA-API) zur Verfügung gestellt.
Berechtigte Nutzerinnen und Nutzer
Gemäß § 21 Absatz 2 DiGAV sind Dritte, sofern dies für die Verwendung von elektronischen Verordnungen der Leistungen nach § 33a Absatz 1 des Fünften Buches Sozialgesetzbuch (SGB V) erforderlich ist, zur Nutzung der DiGA-API berechtigt.
Darüber hinaus können gemäß § 21 Absatz 3 DiGAV folgende Berechtigte einen Zugang zur DiGA-API beantragen:
- Dritte nach § 303e Absatz 1 SGB V
- Sonstige öffentliche Stellen des Bundes, der Länder oder Gemeinden
- Gemeinnützige juristische Personen des Privatrechts
Antragsverfahren zur Nutzung der DiGA-API
Berechtigte Nutzerinnen und Nutzer können einen entsprechenden Antrag zur Nutzung der DiGA-API stellen. Um den Antrag auf Nutzung der Schnittstelle stellen zu können, ist vorab die Anlage eines Nutzerkontos im elektronischen Antragsportal für DiGA erforderlich. Die Registrierung als Nutzerin oder Nutzer erfolgt unter der URL https://antrag-api.bfarm.de. Mit dem Nutzerkonto können sich Nutzerinnen und Nutzer im elektronischen Antragsportal anmelden, um einen Antrag auf Nutzung der Schnittstelle zu stellen. Nach Prüfung der Nutzungsberechtigung übermittelt das BfArM per E-Mail eine Information über die Annahme oder Ablehnung des Antrags.
Technische Spezifikation der DiGA-API
Bei der DiGA-API handelt es sich um eine auf dem internationalen Standard FHIR (Fast Healthcare Interoperability Resources) basierte Programmierschnittstelle (sog. REST-API, REpresentational State Transfer Application Programming Interface), welche eine automatisierte Echtzeit-Abfrage von strukturierten Daten aus dem DiGA-Verzeichnis des BfArM ermöglicht. Die technische Dokumentation der DiGA-API ist auf simplifier.net/guide/diga veröffentlicht. Die Schnittstellen-Dokumentation enthält eine Beschreibung der über die Schnittstelle ausgelieferten Daten sowie des gesamten Datenmodells, Anwendungsbeispiele und eine Änderungshistorie (Changelog), über welche Änderungen an der Schnittstelle dokumentiert werden.
Beiträge zu digitalen Gesundheitsanwendungen (DiGA) im Bundesgesundheitsblatt
Die gesundheitswissenschaftliche Fachzeitschrift Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz publiziert Beiträge, die sich mit Fragestellungen und Bereichen des öffentlichen Gesundheitswesen und der staatlichen Gesundheitspolitik auseinandersetzen. Themenhefte, in denen Amtsaufgaben des BfArM Leitthema sind, stehen zum freien Download zur Verfügung.
Die Oktoberausgabe 2021 beinhaltet Beiträge zum Leitthema "Digitale Gesundheitsanwendungen (DiGA)",
siehe Bundesgesundheitsblatt, Band 64, Heft 10, Oktober 2021
