Therapiebegleitende Diagnostika (CDx)
Definition und Klassifizierung
Die IVDR definiert ein therapiebegleitendes Diagnostikum (companion diagnostic, CDx) folgendermaßen (Artikel 2, 7 IVDR):
Ein "therapiebegleitendes Diagnostikum" bezeichnet ein Produkt, das für die sichere und wirksame Verwendung eines dazugehörigen Arzneimittels wesentlich ist, um
- Patienten vor und/oder während der Behandlung zu identifizieren, die mit der größten Wahrscheinlichkeit von dem dazugehörigen Arzneimittel profitieren, oder
- Patienten vor und/oder während der Behandlung zu identifizieren, bei denen wahrscheinlich ein erhöhtes Risiko von schwerwiegenden unerwünschten Reaktionen infolge einer Behandlung mit dem dazugehörigen Arzneimittel besteht;
Ob ein IVD die Kriterien eines CDx erfüllt, hängt wesentlich davon ab, ob der Nachweis des Biomarkerstatus für die Therapieentscheidung zwingend erforderlich ist, um eine sichere und wirksame Verwendung des Arzneimittels sicherzustellen. Alleinig die analytische Qualität, einen bestimmten Biomarker nachzuweisen, ist kein hinreichendes Kriterium für ein CDx.
Im Erwägungsgrund 12 IVDR wird zudem darauf hingewiesen, dass Produkte, die zum "monitoring" eingesetzt werden, nicht unter die Definition eines CDx fallen:
Produkte, die zur Überwachung der Behandlung mit einem Arzneimittel eingesetzt werden, um sicherzustellen, dass die Konzentration der betreffenden Stoffe im menschlichen Körper innerhalb des Therapiefensters liegt, gelten nicht als therapiebegleitende Diagnostika (Erwägungsgrund 12, IVDR).
Mit Geltungsbeginn der IVDR wurde ein Klassifizierungssystem (Klasse A bis D) eingeführt. Hiernach werden CDx mindestens der Klasse C zugeordnet (IVDR, Anhang VIII, Regel 3f: Produkte werden der Klasse C zugeordnet, wenn sie folgende Zweckbestimmung haben: Einsatz als therapiebegleitende Diagnostika). Hilfestellung zur Auslegung der einzelnen Klassifizierungsregeln inklusive Beispiele können der von der Medical Device Coordination Group (MDCG) der EU veröffentlichten Leitlinie MDCG 2020-16 entnommen werden.
Bereiche mit besonderen regulatorischen Anforderungen an CDx gemäß IVDR
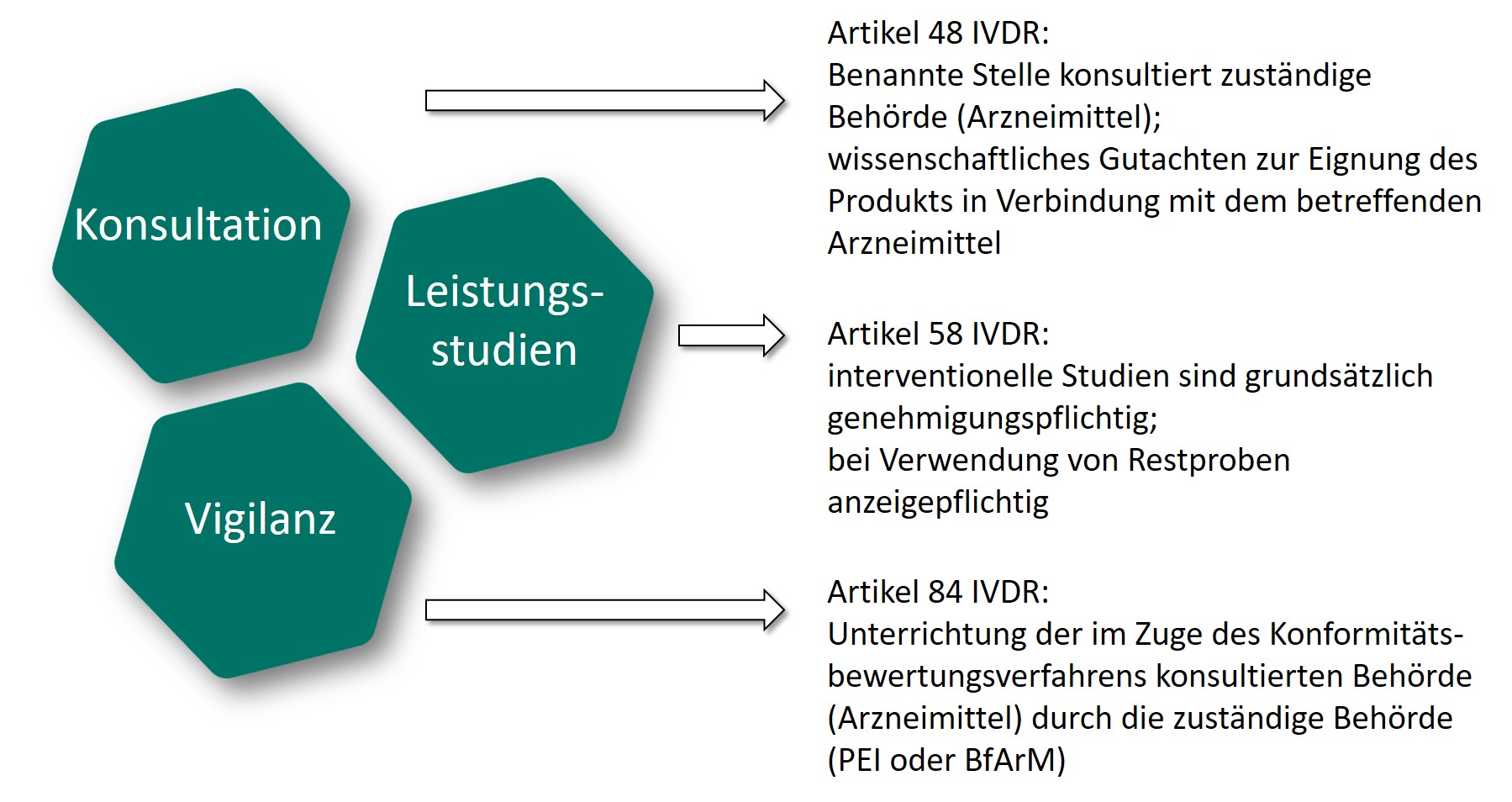
An CDx werden in mehreren Bereichen zusätzliche regulatorische Anforderungen gestellt.
Konsultation im Zuge der Konformitätsbewertung
Im Zuge des Konformitätsbewertungsverfahrens von CDx ist von der Benannten Stelle ein Gutachten bei der für die Zulassung des Arzneimittels zuständigen Behörde (nationale Behörde oder EMA) einzuholen und gebührend zu berücksichtigen (Artikel 48 IVDR). Informationen und Hinweise zum Ablauf des Konsultationsverfahrens hat die EMA in Form einer Leitlinie und weiterer Dokumente auf der Website der EMA unter dem Unterpunkt "Companion diagnostic" veröffentlicht:
Ansprechpartner für Fragen bezüglich der Konformitätsbewertungsverfahren sind die Benannten Stellen:
Generelle Informationen zur Arzneimittelzulassung und Ansprechpersonen finden Sie hier:
Leistungsstudien mit CDx
Für die Genehmigung von Leistungsstudien für therapiebegleitende Diagnostika (CDx-Leistungsstudien), gelten grundsätzlich dieselben Anforderungen wie für alle IVD-Leistungsstudien. Gemäß IVDR sind interventionelle klinische Leistungsstudien genehmigungspflichtig. Eine Besonderheit stellen CDx-Leistungsstudien dar, bei denen nur Restproben verwendet werden: Diese müssen der zuständigen Behörde angezeigt werden (Artikel 58 IVDR). Je nach Produkt ist in Deutschland entweder das BfArM oder das PEI zuständig (§ 85 MPDG).
Die IVDR macht zudem in den Erwägungsgründen deutlich, dass auch alle allgemeinen Anforderungen und andere zusätzliche Anforderungen, die sich auf den Datenschutz beziehen, und die Anforderungen, die für gemäß dem nationalen Recht durchgeführte Verfahren — wie die ethische Überprüfung — gelten, weiterhin für sämtliche Leistungsstudien gelten, einschließlich derjenigen, bei denen Restproben verwendet werden (Erwägungsgrund 73 IVDR). CDx-Leistungsstudien mit Restproben, die in Deutschland anzeigepflichtig sind, bedürfen also einer Bewertung durch eine Ethik-Kommission.
Weitere Informationen und Antworten auf häufig gestellte Frage zum Thema Leistungsstudien finden Sie auf der Seite Klinische Prüfungen und Leistungsstudien.
Risikobewertung bei Vorkommnismeldungen zu CDx
Bei der Bewertung von Vorkommnismeldungen nach dem Inverkehrbringen eines CDx wird gemäß IVDR grundsätzlich so verfahren, wie auch für alle anderen IVD. Im Falle von CDx unterrichtet die bewertende zuständige Behörde zudem die nationale Arzneimittelbehörde oder die EMA, je nachdem welche Stelle im Zuge des Konformitätsbewertungsverfahrens von der Benannten Stelle kontaktiert wurde über die Bewertung (Artikel 84, 6 IVDR).
Zuständigkeiten auf nationaler Ebene
Die Zuständigkeiten der beiden Bundesoberbehörden, BfArM und PEI, werden auf nationaler Ebene im MPDG geregelt (§ 85 MPDG).
Tabelle: Aufteilung der Zuständigkeiten auf die Bundesoberbehörden, BfArM und PEI, für CDx der Klasse C (Regel 3f, Anhang VIII, IVDR) gemäß § 85 MPDG. Die Zuständigkeit für das Arzneimittel ist im Arzneimittelgesetz geregelt (§ 77 Absatz 2 AMG).
| BfArM | PEI | |
| Leistungsstudie | Genehmigung oder bei der Verwendung von Restproben Anzeige, wenn für Arzneimittel zuständig | Genehmigung oder bei der Verwendung von Restproben Anzeige, wenn für Arzneimittel zuständig |
| Konsultation | Gutachten, wenn für Arzneimittel zuständig (Rapporteur)* | Gutachten, wenn für Arzneimittel zuständig (Rapporteur)* |
| Vigilanz | Risikobewertung alle CDx | Stellungnahme an BfArM, wenn das PEI für das Arzneimittel zuständig ist |
| Klassifizierung / rechtlicher Status | Entscheidung | keine Zuständigkeit |
| Genehmigungspflicht einer Leistungsstudie | Entscheidung | keine Zuständigkeit |
* EMA-guidance on procedural aspects for the consultation to the EMA by a NB
CDx der Klasse C fallen in den Zuständigkeitsbereich des BfArM. Eine Ausnahme stellt die Genehmigung eines Antrags auf Leistungsstudie unter Einbezug eines therapiebegleitenden Diagnostikums dar. Fällt das zugehörige Arzneimittel nach § 77 Absatz 2 des Arzneimittelgesetzes in den Zuständigkeitsbereich des PEI, so ist der Antrag auf Genehmigung der entsprechenden Leistungsstudie beim PEI zu stellen. Anzeigen von CDx-Leistungsstudien, bei denen nur Restproben verwendet werden, werden ebenfalls der Bundesoberbehörde angezeigt, die für das Arzneimittel zuständig ist.
Die Zuständigkeit für die Bearbeitung von Risikomeldungen nach Inverkehrbringen des IVD liegt für CDx der Klasse C beim BfArM. Das MPDG sieht allerdings vor, dass das BfArM eine Stellungnahme des PEI einzuholen hat, wenn das zugehörige Arzneimittel im Zuständigkeitsbereich des PEI liegt.
Weitere Informationen: Dialogveranstaltung
Im Mai 2022 haben die beiden Bundesoberbehörden PEI und BfArM zu einer gemeinsamen Dialogveranstaltung eingeladen, in der über die Änderungen rechtlicher Vorgaben und praktischer Rahmenbedingungen für das Inverkehrbringen, die Genehmigung und Durchführung von Leistungsstudien mit IVD und die Bewertung von Risiken bei der Anwendung der Produkte informiert wurde.
Das BfArM bietet zudem im Rahmen seiner Zuständigkeit verschiedene Beratungsverfahren an, um wissenschaftliche oder verfahrenstechnische Fragen zu diskutieren.
