Konformitätsbewertung
Voraussetzung für das Inverkehrbringen als Medizinprodukt
Anders als Arzneimittel werden Medizinprodukte im Europäischen Wirtschaftsraum (EWR) nicht von einer Behörde zugelassen.
Damit ein Hersteller sein Medizinprodukt im EWR in Verkehr bringen darf, muss er eine Konformitätserklärung für das Produkt abgeben. Darin bestätigt er, dass sein Produkt den geltenden gesetzlichen Vorgaben insbesondere an die Sicherheit und die technische wie medizinische Leistungsfähigkeit genügt. Ist dies der Fall, darf der Hersteller das CE-Kennzeichen am Produkt anbringen.

Vor der Erstellung der Konformitätserklärung durchläuft das Produkt ein sogenanntes Konformitätsbewertungsverfahren. Ein Konformitätsbewertungsverfahren kann aus einem oder mehreren Modulen bestehen, die der Hersteller in Abhängigkeit der Risikoeigenschaften des Produkts auswählen kann. Die Module betreffen die Technische Dokumentation des Produkts, das Qualitätsmanagementsystem des Herstellers, einzelne Baumuster, die Sicherung der Produktionsqualität oder die Übereinstimmung der Produkte mit einem Baumuster. So soll nachgewiesen werden, dass der Hersteller über geeignete Prozesse verfügt um die Sicherheit und Leistungsfähigkeit seiner Produkte dauerhaft zu gewährleisten – und dass das einzelne Produkt sicher und leistungsfähig ist.
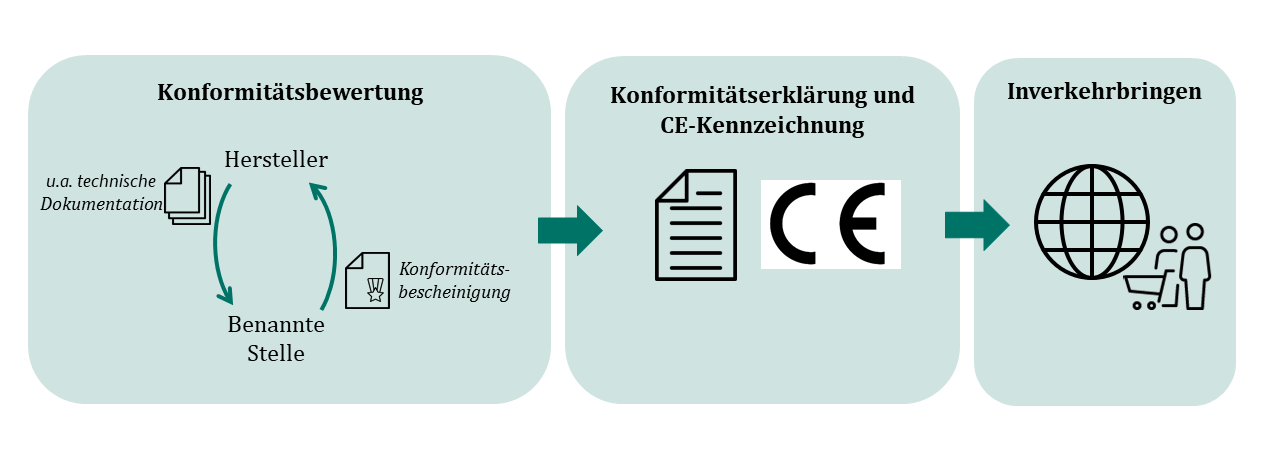
Für viele Produkte muss eine sogenannte Benannte Stelle am Konformitätsbewertungsverfahren beteiligt werden. Benannte Stellen prüfen und bewerten die vom Hersteller durchzuführende Konformitätsbewertung und bescheinigen nach einheitlichen Bewertungsmaßstäben die Übereinstimmung mit den gesetzlichen Vorgaben (sogenannte Konformitätsbescheinigung).
Für die Benennung und Überwachung der Benannten Stellen ist in Deutschland die Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (ZLG) zuständig.
Mehr Informationen zu Benannten Stellen sowie Übersichten über die Benannten Stellen in Deutschland und dem Europäischen Wirtschaftsraum:
NANDO (New Approach Notified and Designated Organisations) Startseite
ZLG - Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten
Welches Konformitätsbewertungsverfahren für ein bestimmtes Produkt in Frage kommt und ob eine Benannte Stelle beteiligt werden muss, hängt in erster Linie von der Risikoeinstufung des Produkts ab. Darüber hinaus muss unterschieden werden zwischen Medizinprodukten, die der Europäischen Verordnung für Medizinprodukte unterliegen, und In-Vitro-Diagnostika, die der Europäischen Verordnung für In Vitro Diagnostika unterliegen.
Medizinprodukte
Für jedes Medizinprodukt muss der Hersteller das Risiko bestimmen, ob bei der Anwendung seines Produkts ein gesundheitlicher Schaden eintreten und wie schwer dieser gesundheitliche Schaden sein kann. Anhand gesetzlicher Vorgaben bestimmt sich dann, ob das Produkt einer niedrigen Risikoklasse oder einer hohen Risikoklasse zuzuordnen ist. Für Medizinprodukte gibt es die Risikoklassen I, IIa, IIb und III. Risikoklasse I entspricht dem geringsten, Risikoklasse III dem größten Risiko. In der Risikoklasse I wird weiter unterschieden zwischen "mit Messfunktion" (Klasse Im) und "steril" (Klasse Is) sowie "wiederverwendbare chirurgische Instrumente".
Die Zuordnung zu einer Risikoklasse nimmt der Hersteller nach gesetzlich festgelegten Regeln selbst vor. Ausgangspunkt für die Risikobestimmung und damit die Zuordnung des Produkts zu einer Risikoklasse ist stets die Zweckbestimmung des Produkts. Dabei wird beispielsweise berücksichtigt, ob ein Produkt invasiv ist, wie lange es angewendet wird oder ob es Energie abgibt.
Die vollständigen Klassifikationsregeln finden sich für Medizinprodukte in Anhang VIII der Verordnung (EU) 2017/745. Gesetze und Verordnungen
Weitere Informationen zum Thema Klassifizierung:
Von der Risikoklasse des Produktes hängt es ab, welches Modul oder welche Modulkombinationen von Konformitätsbewertungsverfahren angewendet werden dürfen. Für Produkte der niedrigsten Risikoklasse (Klasse I), die weder eine Messfunktion haben noch den Zusatz "steril" tragen und bei denen es sich nicht um wiederverwendbare chirurgische Instrumente handelt, kann der Hersteller das Konformitätsbewertungsverfahren ohne Beteiligung einer Benannten Stelle durchführen. Für alle anderen Risikoklassen ist die Beteiligung einer Benannten Stelle zwingend vorgeschrieben.
Die vollständigen Regelungen zur Anwendung der Konformitätsbewertungsverfahren finden sich in Artikel 52 der Verordnung (EU) 2017/745. Gesetze und Verordnungen
Für die Konformitätsbewertung ist das BfArM nicht zuständig. Weitere Informationen zu Benannten Stellen sowie Übersichten über die Benannten Stellen in Deutschland und dem EWR, die unter der Verordnung Medizinprodukte benannt sind:
NANDO (New Approach Notified and Designated Organisations) Notified Bodies - MDR
Klinische Prüfungen
Im Rahmen des Konformitätsbewertungsverfahrens müssen Sicherheit und Leistungsfähigkeit des Produktes auch unter klinischen Anwendungsbedingungen nachgewiesen werden. Der Nachweis kann über klinische Daten erfolgen, die aus der Literatur, aus klinischer Erfahrung oder aus bereits durchgeführten klinischen Prüfungen stammen. Reichen diese Daten nicht aus, wird eine klinische Prüfung an freiwilligen Versuchspersonen vorgenommen.
Eine Voraussetzung zur Durchführung einer klinischen Prüfung ist eine positive Stellungnahme der zuständigen Ethikkommission. Zudem muss eine klinische Prüfung je nach Verfahrenstyp durch die zuständige Bundesoberbehörde (BfArM) genehmigt werden oder dort angezeigt werden.
Mehr Informationen zu klinischen Prüfungen:
Zuständige Ethik-Kommissionen für klinische Prüfungen:
In-vitro-Diagnostika
In-vitro-Diagnostika Richtlinie
Nach bis einschließlich 25. Mai 2022 geltendem Recht (RL 98/79/EG, In-vitro-Diagnostika Richtlinie, IVDD) wurden IVD nicht in Klassen eingeteilt. Nach Artikel 9 IVDD war es für die Wahl des Konformitätsbewertungsverfahren entscheidend, ob es sich um ein Produkt zur Eigenanwendung handelt oder ob das Produkt in Anhang II der IVDD gelistet ist (so genannte Hochrisiko-IVD). Nur für diese Produkte war die Beteiligung einer Benannten Stelle vorgesehen.
In-vitro-Diagnostika Verordnung
Seit Geltungsbeginn der Verordnung (EU) 2017/746 (In-vitro-Diagnostika-Verordnung, IVDR) werden IVD in Risikoklassen eingeteilt. Es gibt die Risikoklassen A bis D. Für spezielle IVD gelten zusätzliche Regelungen: Für IVD, die für die Anwendung durch Laien bestimmt sind (Produkt zur Eigenanwendung), für patientennahe Tests und therapiebegleitende Diagnostika.
Für jedes IVD muss der Hersteller das Risiko bestimmen, ob durch die Anwendung seines Produkts ein gesundheitlicher Schaden eintreten kann und wie schwer dieser gesundheitliche Schaden sein kann. Die Zuordnung zu einer Risikoklasse nimmt der Hersteller des IVD nach gesetzlich festgelegten Regeln selbst vor. Ausgangspunkt für die Risikobestimmung und damit die Zuordnung des Produkts zu einer Risikoklasse ist stets die Zweckbestimmung des Produkts. Dabei wird beispielsweise berücksichtigt, ob das IVD dazu dient, einen übertragbaren, potenziell lebensbedrohlichen Erreger nachzuweisen, ob es sich um ein Produkt zur Blutgruppenbestimmung oder Gewebetypisierung handelt oder um ein Produkt zur Früherkennung bestimmter Krebsarten.
Die vollständigen Klassifikationsregeln finden sich in Anhang VIII der Verordnung (EU) 2017/746. Gesetze und Verordnungen
Weitere Informationen zum Thema Klassifizierung:
Von der Risikoklasse des IVD hängt es ab, welches Modul oder welche Modulkombinationen von Konformitätsbewertungsverfahren angewendet werden können. Für IVD der niedrigsten Risikoklasse (Klasse A), die nicht den Zusatz "steril" tragen, kann der Hersteller das Konformitätsbewertungsverfahren ohne Beteiligung einer Benannten Stelle durchführen. Für alle anderen Risikoklassen ist die Beteiligung einer Benannten Stelle zwingend vorgeschrieben.
Die vollständigen Regelungen zur Anwendung der Konformitätsbewertungsverfahren finden sich in Artikel 48 der Verordnung (EU) 2017/746. Gesetze und Verordnungen
Für die Konformitätsbewertung ist das BfArM nicht zuständig. Weitere Informationen zu Benannten Stellen sowie Übersichten über die Benannten Stellen in Deutschland und dem EWR, die unter der Verordnung für In-Vitro-Diagnostika benannt sind:
NANDO (New Approach Notified and Designated Organisations) Notified Bodies - IVDR
IVD, die gemäß der Richtlinie 98/79/EG in Verkehr gebracht wurden, dürfen für eine Übergangsfrist in Verkehr bleiben. Die Dauer der Übergangsfrist hängt davon ab, in welche Risikoklasse das IVD nach IVDR fallen würde. Als Faustregel gilt: Je höher die voraussichtliche Risikoklasse, desto kürzer die Übergangsfrist.
Leistungsstudien
Im Rahmen des Konformitätsbewertungsverfahrens müssen Sicherheit und Leistungsfähigkeit des Produktes klinisch nachgewiesen werden. Der Nachweis kann über klinische Daten erfolgen, die aus der Literatur, aus klinischer Erfahrung oder aus bereits durchgeführten Leistungsstudien stammen. Reichen diese Daten nicht aus, wird eine Leistungsstudie an von freiwilligen Versuchspersonen bereitgestelltem Probenmaterial vorgenommen.
Eine Voraussetzung zur Durchführung einer Leistungsstudie ist eine positive Stellungnahme der zuständigen Ethikkommission. Zudem muss eine Leistungsstudie je nach Verfahrenstyp durch eine Bundesoberbehörde (BfArM oder PEI) genehmigt oder dort angezeigt werden.
Mehr Informationen zu Leistungsstudien:
Zuständige Ethik-Kommissionen für Leistungsstudien:
Sonderzulassungen
Unter strengen Voraussetzungen kann ein Hersteller in Ausnahmefällen ein Medizinprodukt auch ohne ein Konformitätsbewertungsverfahren über eine sogenannte Sonderzulassung in Verkehr bringen. Dieses Verfahren kommt nur in Frage, wenn der Gesundheitsschutz nicht auf andere Weise gewährleistet werden kann. Dies war beispielsweise während der Coronavirus-Pandemie der Fall (Mund-Nasen-Schutz, Antigen-Schnelltests zur Eigenanwendung).
